- история
- Возникновение и свойства
- аллотропия
- Препаративные методы
- Коммерческое производство и использование
- Химические свойства и реакции
Кислород (O) , неметаллический химический элемент группы 16 (VIa или кислородная группа ) из периодическая таблица , Кислород бесцветный, без запаха, без вкуса газ необходим для живых организмов, которые поглощаются животными, которые превращают его в углерод диоксид; растения, в свою очередь, утилизируют углекислый газ в качестве источника углерода и возврата кислорода в атмосферу. Кислородные формы соединений реакцией практически с любым другим элементом, а также реакциями, которые вытесняют элементы из их комбинаций друг с другом; во многих случаях эти процессы сопровождаются выделением тепла и света и в таких случаях называются ожогами. Его самое главное соединение является воды ,
Читать дальше на эту тему
сталь: удаление кислорода
Когда уровень углерода в жидкой стали снижается, уровень растворенного кислорода теоретически увеличивается в соответствии с соотношением% C ×…
Свойства элемента атомный номер 8, атомный вес 15.9994, точка плавления -218,4 ° C (-361,1 ° F), точка кипения -183,0 ° C (-297,4 ° F), плотность (1 атм, 0 ° C), 1,429 г / л, степень окисления -1, -2, +2 (в соединениях с фтором) электронный конфиг. 1 с 22 с 22 р 4
история
Кислород был открыт около 1772 года шведским химиком, Карл Вильгельм Шееле кто получил это нагреванием калий нитрат ртутный оксид и многие другие вещества. Английский химик, Джозеф Пристли независимо обнаружил кислород в 1774 году путем термического разложения оксида ртути и опубликовал свои выводы в том же году, за три года до публикации Шееле. В 1775–80, французский химик Антуан-Лоран Лавуазье т, с замечательной проницательностью, интерпретировал роль кислорода в дыхании, а также сгорание , отбрасывая флогистон теория, которая была принята до того времени; он отметил его склонность к образованию кислот путем сочетания со многими различными веществами и, соответственно, назвал кислородный элемент ( оксиген ) от греческого слова «кислотный формирователь».
Возникновение и свойства
На 46 процентов массы кислород является наиболее обильным элементом в Земли корка. Доля кислорода по объему в атмосфере составляет 21 процент, а по весу морская вода составляет 89 процентов. В породах он сочетается с металлами и неметаллами в виде оксидов, которые являются кислыми (такими как сера , углерод, алюминий и фосфор) или основной (такой как кальций , магний и железа) и в виде солеподобных соединений, которые можно рассматривать как образованные из кислых и основных оксидов, таких как сульфаты, карбонаты, силикаты, алюминаты и фосфаты. Эти твердые соединения в изобилии не пригодны в качестве источников кислорода, потому что отделение элемента от его плотных сочетаний с металл атомы слишком дороги.
Ниже −183 ° С (-297 ° F), кислород представляет собой бледно-голубую жидкость; оно становится твердым примерно при -218 ° C (-361 ° F). Чистый кислород в 1,1 раза тяжелее воздух ,
Получите неограниченный доступ без рекламы ко всему доверенному контенту Britannica. Начните бесплатную пробную версию сегодня
Во время дыхания животных и некоторых бактерии взять кислород из атмосферы и вернуть ему углекислый газ, тогда как фотосинтез , зеленые растения усваивать углекислого газа в присутствии солнечного света и выделяют свободный кислород. Почти весь свободный кислород в атмосфере происходит из-за фотосинтеза. Приблизительно 3 части кислорода по объему растворяются в 100 частях пресной воды при 20 ° C (68 ° F), чуть меньше в морской воде. Растворенный кислород необходим для дыхания рыб и других морских обитателей.
Природный кислород представляет собой смесь трех стабильных изотопов: кислорода-16 (99,759 процента), кислорода-17 (0,037 процента) и кислорода-18 (0,204 процента). Известно несколько искусственно приготовленных радиоактивных изотопов. Кислород-15 с наибольшим сроком годности (период полураспада 124 секунды) был использован для изучения дыхания у млекопитающих.
аллотропия
Кислород имеет две аллотропные формы, двухатомную (O2) и трехатомную (O3, озон). Свойства двухатомной формы предполагают, что шесть электронов связывают атомы, а два электрона остаются непарными, что объясняет парамагнетизм кислорода. Три атома в озон молекула не лежите по прямой линии.
Озон может быть получен из кислорода в соответствии с уравнением:

Процесс, как написано, является эндотермическим (энергия должна быть обеспечена, чтобы он продолжался); преобразованию озона обратно в двухатомный кислород способствует присутствие переходных металлов или их оксидов. Чистый кислород частично превращается в озон бесшумным электрическим разрядом; реакция также вызвана поглощением ультрафиолетовый свет с длиной волны около 250 нанометров (нм, нанометр, равный 10–9 метрам); Возникновение этого процесса в верхних слоях атмосферы удаляет радиацию, которая была бы вредна для жизни на поверхности Земли. Острый запах озона заметен в замкнутых пространствах, в которых возникает искрение электрооборудования, например в генераторных помещениях. Озон светло-голубой; его плотность в 1,665 раза больше, чем у воздуха, и имеет точка кипения -112 ° C (-170 ° F) при атмосферное давление ,
Озон является мощным окислителем, способным превращать диоксид серы до триоксида серы, сульфидов до сульфатов, йодидов до йод (предоставляя аналитический метод для его оценки), а также многие органические соединения с кислородсодержащими производными, такими как альдегиды и кислоты. Превращение озоном углеводородов из автомобильных выхлопных газов в эти кислоты и альдегиды способствует раздражающей природе смог , В промышленных масштабах озон используется в качестве химического реагента, в качестве дезинфицирующего средства в очистка сточных вод , очистка воды и отбеливание текстиля.
Препаративные методы
Методы производства, выбранные для кислорода, зависят от количества желаемого элемента. Лабораторные процедуры включают в себя следующее:
1. Термическое разложение некоторых солей, таких как хлорат калия или нитрат калия:
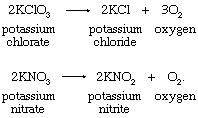
Разложение хлората калия катализируется оксидами переходных металлов; марганец часто используется диоксид (пиролузит, MnO2). Температура, необходимая для выделения кислорода, снижается с 400 до 250 ° С катализатор ,
2. Термическое разложение оксидов тяжелых металлов:
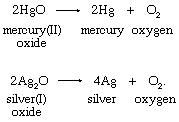
Шееле и Пристли использовали оксид ртути (II) в своих препаратах кислорода.
3. Термическое разложение пероксидов металлов или водород перекись:
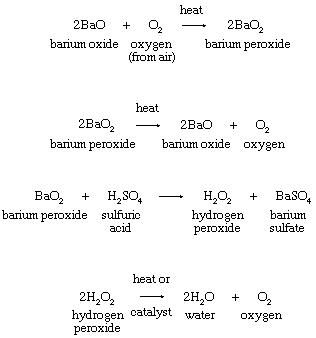
Ранняя коммерческая процедура для выделения кислорода из атмосферы или для производства пероксид водорода зависело от формирования барий перекись из оксида, как показано в уравнениях.
4. Электролиз воды, содержащей небольшие доли солей или кислот, для обеспечения возможности проведения электрического тока:

Коммерческое производство и использование
Когда требуется в тоннажных количествах, кислород готовится фракционным дистилляция жидкого воздуха. Из основных компонентов воздуха кислород имеет самую высокую температуру кипения и поэтому является менее летучим, чем азот а также аргон , Процесс использует преимущество того факта, что, когда сжатому газу позволяют расширяться, он охлаждается. Основные этапы операции включают в себя следующее: (1) воздух фильтруется для удаления твердых частиц; (2) влага и диоксид углерода удаляются путем абсорбции щелочью; (3) воздух сжимается и тепло сжатия отводится обычными процедурами охлаждения; (4) сжатый и охлажденный воздух передается в змеевики, содержащиеся в камере; (5) часть сжатый воздух (при давлении около 200 атмосфер) расширяется в камере, охлаждая катушки; (6) расширенный газ возвращается в компрессор с несколькими последующими этапами расширения и сжатия, что в конечном итоге приводит к сжижению сжатого воздуха при температуре -196 ° C; (7) жидкому воздуху дают нагреться, чтобы отогнать сначала легкие редкие газы, затем азот, оставляя жидкий кислород. Многократное фракционирование даст достаточно чистый продукт (99,5%) для большинства промышленных целей.
сталь Промышленность является крупнейшим потребителем чистого кислорода для «выдувания» высокоуглеродистой стали, то есть улетучивания углекислого газа и других неметалл примеси в более быстром и более легко контролируемом процессе, чем при использовании воздуха. Очистка сточных вод кислородом обещает более эффективную очистку жидких стоков, чем другие химические процессы. Сжигание отходов в закрытых системах с использованием чистого кислорода стало важным. Так называемый LOX ракета окислитель топлива - жидкий кислород; потребление LOX зависит от активности космических программ. Чистый кислород используется в подводных лодках и водолазных колоколах.
Коммерческий кислород или обогащенный кислородом воздух заменил обычный воздух в химическая индустрия для изготовления таких химических веществ, контролируемых окислением, как ацетилен , этилен оксид и метанол , Медицинское применение кислорода включает использование в кислородных палатках, ингаляторах и детских инкубаторах. Обогащенные кислородом газообразные анестетики обеспечивают поддержку жизни во время общей анестезии. Кислород имеет большое значение в ряде отраслей, которые используют печи.
Химические свойства и реакции
Большие значения электроотрицательность и сродство к электрону кислорода характерны для элементов, которые показывают только неметаллическое поведение. Во всех своих соединениях кислород предполагает отрицательный степень окисления как ожидается от двух наполовину заполненных внешних орбиталей. Когда эти орбитали заполнены переносом электрона, образуется ион оксида O2−. В пероксидах (разновидностях, содержащих ион O22-) предполагается, что каждый кислород имеет заряд -1. Это свойство принимать электроны путем полного или частичного переноса определяет окислитель. Когда такой агент реагирует с электронодонорным веществом, его собственная степень окисления понижается. Изменение (понижение) от нуля до состояния -2 в случае кислорода называется редукцией. Кислород можно рассматривать как «оригинальный» окислитель, номенклатура используется для описания окисления и восстановления на основе этого поведения, характерного для кислорода.
Как описано в разделе аллотропия кислород образует двухатомные частицы O2 в нормальных условиях, а также трехатомный вид озона O3. Есть некоторые свидетельства очень нестабильного четырехатомного вида, О4. В молекулярной двухатомной форме есть два неспаренных электрона, которые находятся на антисвязывающих орбиталях. Парамагнитное поведение кислорода подтверждает наличие таких электронов.
Интенсивная реакционная способность озона иногда объясняется предположением, что один из трех атомов кислорода находится в «атомном» состоянии; при реакции этот атом диссоциирует от молекулы О3, оставляя молекулярный кислород.
Молекулярные частицы, O2, не особенно реактивны при нормальных (окружающих) температурах и давлениях. Атомный вид О, гораздо более реактивный. Энергия диссоциации (O2 → 2O) велика и составляет 117,2 ккал на моль.
Кислород имеет степень окисления -2 в большинстве его соединений. Он образует большой спектр ковалентно связанных соединений, среди которых есть оксиды неметаллов, такие как вода (H2O), диоксид серы (SO2) и диоксид углерода (CO2); органические соединения, такие как спирты, альдегиды и карбоновые кислоты; обычные кислоты, такие как серная (H2SO4), угольная (H2CO3) и азотная (HNO3); и соответствующие соли, такие как натрий сульфат (Na2SO4), карбонат натрия (Na2CO3) и нитрат натрия (NaNO3). Кислород присутствует в виде оксидного иона O2- в кристаллической структуре твердых оксидов металлов, таких как оксид кальция, CaO. Металлические супероксиды, такие как супероксид калия, KO2, содержат ион O2, в то время как пероксиды металлов, такие как пероксид бария, BaO2, содержат ион O22.
Роберт С. БрастедПохожие
Римская математика - история математики... ине 1-го века до нашей эры римляне усилили свою власть на старом греческий а также Эллинистическая империи, и математическая революция греки земля, чтобы остановить Несмотря на все их достижения в других отношениях, в Римской империи и Республике не было никаких математических новшеств, и не было никаких заметных математиков"> РИМСКАЯ МАТЕМАТИКА К середине 1-го века до нашей эры римляне усилили свою власть на старом Типы и свойства химических связей
Свободные атомы могут быть связаны с более крупными скоплениями - молекулами с помощью взаимодействий, называемых химическими связями. Существует несколько типов взаимодействий, которые отличаются силой сцепления. Ваши основные типы сильны - ковалентные и слабые связи. Первые из них очень долговечны при физиологических температурах, а последние, если они встречаются по отдельности, легко ломаются даже при низких температурах. С другой стороны, слабые связи, встречающиеся в группах, имеют Молекулярный генератор водорода нано пузырьковый инфузионный насос кислород вода вода кислород
Водородные технологии, генераторы молекулярного водорода / кислорода и инфузионные насосы с нанопузырьками являются самыми современными электролизными установками на рынке. Машина позволяет пользователю максимизировать большинство преимуществ для здоровья, которые молекулярный водород может предложить в таком широком диапазоне применений. Наша запатентованная конструкция генератора позволяет малым и крупным пользователям использовать газообразный молекулярный водород для множества отраслей Эмоции растут, или методы валоризации в школе
... использованием методов олицетворения студент должен получить информацию о создателе и его работе. Благодаря этим видам работ мы обучаем детей и подростков приему различных произведений искусства и формируем отношение к участию в культуре. Методы впечатления также способствуют собственной активности учеников в отношении проблем принадлежности к школе, местному, региональному и национальному сообществу. Важно, чтобы студенты были сосредоточены и имели возможность выбирать уровень Необычный сад в центре города. И в этом история пчел
Полевая игра в саду лекарственных растений на ал. Hallera 107 в Гданьске. «Когда пчелы исчезнут, человеческому роду останется всего четыре года», - сказал однажды Альберт Эйнштейн. Сад лекарственных растений ... ия бренда Адидас (англ. Adidas), также как и его предшественника Дасслер, берет начало в послевоенной Германи...
... ия бренда Адидас (англ. Adidas), также как и его предшественника Дасслер, берет начало в послевоенной Германии. Вот только Дасслер появился после Первой мировой войны, а Адидас после Второй мировой. Девиз компании Adidas - Невозможное возможно! Двигаться вперед, преодолевая препятствия, и открывать для себя новые горизонты - вот жизненные ценности бренда. Как все начиналось ... После окончания Моя история об экзамене CPA: Достижение успеха в качестве работающей мамы
Дженнифер Гарсия - мать Оливии, 8 лет, и Эм ма, 3 года. Она окончила колледж в штате Иллинойс в 2000 году и работала аудитором до 2002 года. Недавно она поделилась с нами своей поездкой на экзамен CPA, включая ее опыт работы с ТРЕЙЛЕР! Искусство любви. История Михалины Вислоцкой
Михалина Вислоцка - автор книги "Sztuka kochania" в Польской Народной Республике. Магдалена Бочарская сыграет ее. У нас есть трейлер фильма! Посмотрите, как это обещает быть одним из самых известных фильмов в ближайшие месяцы! «Искусство любви» Михалины Вислоцкой В субботу, 21 мая, на съемках нового фильма была снята команда, ответственная за успех «Богов». Режиссер Мария Садовская. «Искусство любви» - это история доктора Михалины Вислоцкой - женщины, которая Массарандуба - происхождение, свойства и применение
Экзотическое дерево очень охотно используется в польской строительной, ремонтной и отделочной промышленности. Одним из видов дерева с интересными цветами является массарандуба. Что отличает их от других экзотических видов? Происхождение дерева Массарандуба классифицируется СВОЙСТВА ЭЛЕКТРОЛИТОВ
... свойства проводимости которых могут быть в значительной степени изменены внешними факторами. Это химические соединения различных элементов, особенно углерода и кремния, а также различные смеси неорганических и органических соединений. Селен, кремний и германий имеют особое значение. Очень хорошими проводниками являются металлы, в которых свободные электроны ответственны за проведение тока. Если по проводнику ток не течет, то направление движения электронов является Алмаз и графит: свойства, значение, происхождение
... ие: И алмаз, и графит - это разные формы одного и того же элемента - углерода. В мягкого, крошится графита и у самого твердого кристалла в мире одна и та же формула - С. Как такое возможно? Свойства алмаза и графита Алмазы встречаются в природе в хорошо выраженной кристаллической форме. Это прозрачный и чаще всего бесцветный кристалл,
Комментарии
Есть ли у ESO discovery какое-либо коммерческое использование?Есть ли у ESO discovery какое-либо коммерческое использование? Все это не обеспечивает немедленного практического перевода в нашу повседневную жизнь. Для возможного коммерческого применения гравитационных волн или знания о них дорога еще далеко. Мы только начали интересоваться ими. Давайте вспомним, что GPS-навигация, используемая в настоящее время почти всеми, была бы невозможной без теории Эйнштейна, созданной 100 лет назад. Возможно, через 5 лет, может быть, Может ли такая история перевернуть мир с ног на голову?
Может ли такая история перевернуть мир с ног на голову? Имеет ли это право принимать важные решения относительно вашего места жительства и связывать судьбу людей, которых вы никогда раньше не видели? Или, может быть, трогательная история о спасении жизни, которая пытается заново построить свою жизнь?
Или, может быть, трогательная история о спасении жизни, которая пытается заново построить свою жизнь? Мы уверены, что каждый найдет что-то для себя среди книг, которые скоро поступят в книжные магазины. Мы составили список по дате релиза. Мы не можем ждать! AJ Финн, Женщина в окне Как пойдет история главного героя?
Как пойдет история главного героя? Позволит ли сбежать из города ей снова встать на ноги и снова обрести счастье? Помимо Урочиски, у Магдалены Кордель есть такие романы, как « Тайна сирени» , « Надежды и мечты» , « Вино с Мальвиной» , « Вид из окна» , «Время мечты», «Дом мечты» и « Сезон чудес» . Скоро, то есть 7 ноября, на издательском рынке появится последняя книга. Ангел в аренду Разве это не невероятно, что почти 4000-летняя история писем так сильно изменилась за сто лет?
Разве это не невероятно, что почти 4000-летняя история писем так сильно изменилась за сто лет? Напиши письмо! В такой почтовый ящик вы должны вставить свое письмо в конце, чтобы он прибыл туда, куда он идет. (Фото: дпа) Этот четверг - Всемирный день письма. Почему бы не использовать те же методы, что и раньше?
Почему бы не использовать те же методы, что и раньше? Это правда, что есть другие, которые кажутся мне более удобными, но они также часто используются даже профессиональными гипнотерапевтами. Как обычно, все будет гораздо проще, чем при самогипнозе, но к этому нужно привыкнуть эпилог Вы могли написать и написать о подсознательных движениях. В действительности они используются во многих бессознательных методах контакта с подсознанием (о, я даже не упомянул автоматическое Это старая история о женах, которую ты продолжаешь слышать, правда?
Это старая история о женах, которую ты продолжаешь слышать, правда? Проведите дополнительное исследование и поделитесь им со зрителями. 4.36 ТВОРЧЕСКИЕ ВИДЕО ИДЕИ YOUTUBE • обсудить историю Обсудить страну и ее историю Сколько людей на самом деле знают настоящую историю страны? Перенесите своих зрителей в другое место и время, поделившись историей разных стран. Почему использование словарных карточек-складанок даст нужный результат в обучении грамоте детей 1 класса?
Почему использование словарных карточек-складанок даст нужный результат в обучении грамоте детей 1 класса? Когда пересмотреть «Критерии оценки начальной школы», видим, что самые высокие баллы предоставляются ребенку когда она «... умело читает текст целыми словами». Зато самый низкий уровень в 1 классе определяется как то, когда ребенок «... читает составами не сливаясь их в слова». (Критерии оценивания учебных достижений учеников по Сборщик данных - где его использование?
Сборщик данных - где его использование? Типичные приложения для сбора данных включают в себя: логистика - прием и доставка товара, сканирование логистических этикеток GS1, Сканер склада - складские операции, выполнение заказов, проверка товаров, Что будет с Мартой, у которой сложная жизнь и история?
Что будет с Мартой, у которой сложная жизнь и история? Есть ли еще надежда, несмотря на упущенные ранее возможности, что-то изменится в ее жизни? Небольшая подсказка для вас, шанс, конечно, то, о чем мы можем прочитать в романе, но сможет ли Марта его использовать? Шанс, который получила женщина, был шанс помириться с дочерью, с которой она потеряла связь несколькими годами ранее. Судьба главного героя и его друзей очень сильно меняется, когда молодая девушка Оливия появляется Могу ли я использовать числовые свойства, такие как коэффициенты и множители?
Могу ли я использовать числовые свойства, такие как коэффициенты и множители? И можно ли использовать наиболее распространенные общие факторы, наименее общие факторы и / или свойство распределения для перезаписи числовых выражений? Могу ли я использовать правила экспонент с числовыми выражениями, с рациональными показателями для написания эквивалентных выражений, с рациональными показателями? Числовые линии: Могу ли я определить абсолютные значения или рациональные числа в
Что отличает их от других экзотических видов?
Как такое возможно?
Есть ли у ESO discovery какое-либо коммерческое использование?
Может ли такая история перевернуть мир с ног на голову?
Имеет ли это право принимать важные решения относительно вашего места жительства и связывать судьбу людей, которых вы никогда раньше не видели?
Или, может быть, трогательная история о спасении жизни, которая пытается заново построить свою жизнь?
Или, может быть, трогательная история о спасении жизни, которая пытается заново построить свою жизнь?
Как пойдет история главного героя?
Позволит ли сбежать из города ей снова встать на ноги и снова обрести счастье?
Разве это не невероятно, что почти 4000-летняя история писем так сильно изменилась за сто лет?
 МОЯ ТВОРЧЕСКАЯ ЛАБОРАТОРИЯ
МОЯ ТВОРЧЕСКАЯ ЛАБОРАТОРИЯ