Свободные атомы могут быть связаны с более крупными скоплениями - молекулами с помощью взаимодействий, называемых химическими связями.
Существует несколько типов взаимодействий, которые отличаются силой сцепления. Ваши основные типы сильны - ковалентные и слабые связи. Первые из них очень долговечны при физиологических температурах, а последние, если они встречаются по отдельности, легко ломаются даже при низких температурах. С другой стороны, слабые связи, встречающиеся в группах, имеют большое значение. Сила связи зависит от расстояния связанных атомов - чем больше атомов находится дальше, тем слабее связь.
Биологические системы характеризуются большим разнообразием химических связей, возникающих в них. Важную роль играют как сильные и стабильные ковалентные связи, так и слабые нековалентные связи, которые стабилизируют многие биологические структуры, такие как белок , нуклеиновые кислоты и клеточные мембраны.
Ковалентная связь основана на явлении разделения электронных пар между двумя сильно электроотрицательными атомами, каждый из которых стремится соединить оба электрона. Мы различаем два типа ковалентных связей:
- поляризованный - связь представляет собой обычную пару электронов, смещенную в сторону более электроотрицательного атома, в результате чего на одном из атомов генерируется частичный положительный заряд, а на другом - отрицательный. Поляризованная ковалентная связь возникает между атомами неметаллических элементов, различающихся по электроотрицательности от 0 до 1,7 по шкале Полинга. Молекулы с такой связью могут быть как диполями (например, HCl, H2O), так и нейтральными (например, CO2).
- неполяризованный - созданный двумя одинаковыми фрагментами, например, O-O, Cl-Cl, H3C-CH3. Оба атома электроотрицательны, и каждый из них одинаково сильно притягивает электронные пары.
Твердые ковалентные вещества могут образовывать два типа кристаллов:
- Молекулярный (молекулярный) - состоит из множества молекул, когда они плавятся или растворяются, они распадаются на отдельные молекулы.
- ковалентный - состоит из атомов, связанных ковалентными связями в одну большую "молекулу". Этот тип кристаллов встречается гораздо чаще, например, бриллиант , кремний, карбид кремния.
Свойства ковалентных веществ
Как в жидком, так и в твердом состоянии вещества, построенные из атомов, связанных ковалентными связями, являются электрическими изоляторами - они не проводят электричество. Причиной этого является отсутствие электролитической диссоциации и свободных электронов, которые могут участвовать в процессе проведения тока. Графит является единственным исключением. Легированные (загрязненные) ковалентные вещества могут быть очень хорошими полупроводниками.
Поляризованные ковалентные молекулы растворяются только в полярных растворителях, например в воде, а неполяризованные - в неполярных растворителях.
Вещества, содержащие ковалентные связи, медленно реагируют с другими соединениями, поскольку необходимо обеспечить высокую энергию для разрыва связи. По той же причине соединения, которые составляют молекулярные кристаллы, имеют гораздо более низкие температуры плавления и кипения, чем ковалентные кристаллы.
Водородные связи
Атом водорода, благодаря тому, что он имеет только один электрон, может образовывать только одну ковалентную связь. Однако он способен образовывать другой тип связи, гораздо более слабый - водородную связь, состоящую из слабого электростатического взаимодействия между сильно электроотрицательным атомом (акцептором водородной связи) и атомом водорода, ковалентно связанным с другим сильно электроотрицательным атомом (донором водородной связи). В химических формулах водородная связь обозначена пунктирной линией: N - H. , , , Fr.
Водородные связи играют фундаментальную роль во многих биологических системах. Одним из наиболее важных из них являются молекулы воды, поляризованные водой, которые сильно взаимодействуют друг с другом с помощью водородных связей. Благодаря наличию водородных связей, легкие молекулы воды не испаряются при низких температурах, они только образуют жидкое состояние - только при 100 ° C вода начинает переходить в газообразное состояние. Также лед состоит из молекул H2O, связанных сетью водородных связей:
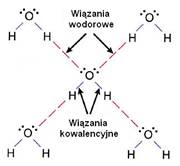
http://witcombe.sbc.edu/water/
Другими важными функциями водородных связей являются повышение растворимости соединений и создание трехмерных структур макромолекул - белков, нуклеиновых кислот, ДНК.
Ионные связи являются еще одним типом химических связей, классифицированных как слабые. Это связывание создается в результате электростатического притяжения между анионом - атомом (фрагментом молекулы), имеющим отрицательный заряд, и катионом - атомом, содержащим положительный заряд, когда разность электроотрицательности больше 1,7 по шкале Полинга. Ионы могут образовываться в результате разрыва ковалентной связи - более электроотрицательный фрагмент «забирает» оба электрона (анион), а менее электроотрицательный фрагмент становится катионом. Примером ионной молекулы является NaCl, в котором разница электроотрицательности настолько велика (Na 0,9, Cl 3,0), что облако электроны полностью притянуты к хлору - распределение нагрузки следующее: Na + Cl-.
Свойства ионных веществ.
Ионные соединения в твердом состоянии образуют ионные кристаллы, состоящие из чередующихся анионов и катионов. Ионы расположены таким образом, что наибольшее количество ионов одного характера окружают каждый из ионов противоположного знака, что эквивалентно достижению наименьшей энергии. Места, занимаемые ионами, являются узлами кристаллической решетки. Число противоположных ионов, окружающих данный ион, описывается посредством координационного числа, в зависимости от отношения размера аниона к катиону. Например, для NaCl, номер координаты LK = 6.
Ионные кристаллы не проводят электричество, в то время как жидкие или растворенные ионные соединения образуют электролиты, в которых ток передается через поток катионов и анионов, подобно движению электронов в проводниках. Это возможно благодаря тому, что ионные вещества диссоциируют.
Ионные соединения хорошо растворяются в полярных растворителях - в основном в воде, но не растворяются в неполярных растворителях - эфирах или бензине.
Из-за низкой энергии связи ионные соединения реагируют очень быстро, в отличие от ковалентных соединений. Однако, несмотря на слабую природу связи, они имеют высокие температуры кипения и плавления - например, для NaCl, t = 801 ° C и tw = 1413 ° C.
Металлические связи возникают в результате электростатического взаимодействия катионов металлов в узлах кристаллической решетки с электронами валентных электронов. Металлические вещества являются отличными электрическими и тепловыми проводниками, и они также имеют различные механические свойства в зависимости от химического состава.

http://www.chemguide.co.uk
Координационное связывание (донор-акцептор) образуется при взаимодействии двух атомов с электронной парой одного из них - донора. Эта связь имеет свойства, очень похожие на поляризованную ковалентную связь.
Похожие
Жидкая форма препарата и растворимость твердых веществмгр фарм. Сильвия Журек преподаватель Медицинского профессионального колледжа В случае жидких лекарств мы можем особенно столкнуться с возникновением различных типов предписывающих несовместимостей, потому что не только терапевтические вещества могут взаимодействовать друг с другом, но также и потому, что их взаимодействие с растворителем должно быть принято во внимание. Наиболее важной проблемой в этой группе препаратов является вопрос правильного растворения кислород
Кислород (O) , неметаллический химический элемент группы 16 (VIa или кислородная группа ) из периодическая таблица , Кислород бесцветный, без запаха, без вкуса газ необходим для живых Простые числа
Простое число, большее 1, которое имеет ровно 2 делителя (один и сам по себе), является простым числом . Натуральное число больше 1, которое не является простым числом, называется комплексным числом . Из-за количества делителей, мы можем все СВОЙСТВА ЭЛЕКТРОЛИТОВ
электролиты Электролит - это вещество, способное проводить электрический ток. Электрический ток проводится через свободные ионы, созданные в таких отношениях в результате: соль плавится, если бы они были в форме твердого вещества электролитическая диссоциация оснований, кислот или их солей, растворенных в растворе или в жидкой форме; Эти электролиты подразделяются на сильные и слабые в зависимости от степени их диссоциации: Массарандуба - происхождение, свойства и применение
Экзотическое дерево очень охотно используется в польской строительной, ремонтной и отделочной промышленности. Одним из видов дерева с интересными цветами является массарандуба. Что отличает их от других экзотических видов? Происхождение дерева Массарандуба классифицируется Алмаз и графит: свойства, значение, происхождение
Лампы низкого энергопотребления: объяснение светодиодов, КЛЛ и галогенов
Я нахожу довольно удивительным, что некоторые люди все еще используют старомодные лампы накаливания, когда современные лампы с низким энергопотреблением намного дешевле в эксплуатации, даже если они немного дороже в покупке. Экономия, которую вы можете сделать, может удивить вас, поскольку они так высоки. Свободное радикальное посвящение: почему требуется «свет» или «жар»?
Если вы столкнетесь с несколькими реакциями со свободными радикалами, вы должны заметить знакомую картину. Каждая реакция со свободными радикалами, с которой вы столкнетесь, сопровождается «жаром» или «светом». На самом деле, это один из самых важных ключей к пониманию того, что вы имеете дело со свободнорадикальной реакцией! Треугольная пирамида
Треугольная пирамида (также называемая тетраэдром ) - это многогранник , поверхность которого образована Руководство по эксплуатации Samsung Galaxy S WiFi 5.0
Этот сайт использует куки для предоставления услуг на самом высоком уровне. Дальнейшее использование сайта означает, что вы соглашаетесь с их использованием. Закрыть Узнать больше https://www.instrukcjaobslugipdf.pl/privacy-policy Справа вы Онлайн курсы по питанию - сертификат MEN, сертификат специалиста
Онлайн-курсы по питанию, проводимые Академией диетологии, представляют собой современные тренинги, проводимые на интерактивной платформе, предлагающей курсы в форме электронного обучения. Наше предложение состоит из курсов по различным темам, тесно связанных со специальными знаниями в области питания и диетологии. Онлайн-курсы предназначены для тех, кто хочет расширить свои знания и повысить свою квалификацию в этой области. Выпускник, заканчивающий
Комментарии
Давайте рассмотрим второй из этих трех пунктов - какие типы материалов могут блокировать попадание фотонов света к нам?Давайте рассмотрим второй из этих трех пунктов - какие типы материалов могут блокировать попадание фотонов света к нам? Если вы рассматриваете только оптический свет, то вы, вероятно, скажете, что свет может проникать сквозь стекло, воздух и воду, но свет легко блокируется твердыми веществами, такими как пластмассы и металлы, или, возможно, облаками в небе. Смотри! Чтобы получить представление о том, какие материалы блокируют свет, я настоятельно рекомендую посмотреть Могу ли я использовать числовые свойства, такие как коэффициенты и множители?
Могу ли я использовать числовые свойства, такие как коэффициенты и множители? И можно ли использовать наиболее распространенные общие факторы, наименее общие факторы и / или свойство распределения для перезаписи числовых выражений? Могу ли я использовать правила экспонент с числовыми выражениями, с рациональными показателями для написания эквивалентных выражений, с рациональными показателями? Числовые линии: Могу ли я определить абсолютные значения или рациональные числа в Какие ключевые слова, слоганы, типы контента и отдельные продукты вызвали наибольшее количество трафика в интернет-магазине или привлекли людей к фиксированной точке продаж?
Какие ключевые слова, слоганы, типы контента и отдельные продукты вызвали наибольшее количество трафика в интернет-магазине или привлекли людей к фиксированной точке продаж? Ответы на вопросы позволят вам сосредоточиться на ваших наиболее ценных ресурсах и скорректировать скидки с учетом предпочтений потребителей. 2. SMS попадает в джекпот SMS-кампания между понедельником и Черной пятницей может дать потрясающие результаты, если она будет правильно подготовлена. Как бы вы сделали первые несколько химических элементов?
Как бы вы сделали первые несколько химических элементов? Вы бы начали с самого простого атома из всех, водорода (символ Н), у которого есть один протон и один электрон, но нет нейтронов. Если вы добавите еще один протон, другой электрон и два нейтрона, вы получите атом гелия (символ Он). Добавьте еще один протон, еще один электрон и еще два нейтрона, и у вас будет атом металлического лития (символ Li). Добавьте один протон, один нейтрон и один электрон, и вы получите атом бериллия (символ Be). Хотите поразить ваше устройство связи?
Хотите поразить ваше устройство связи? Давайте посмотрим, как создать свои собственные обои с PicMonkey. Начните с чистого холста Сделайте свой телефон обои с фотографиями или графикой Экспортируйте свое изображение и добавьте его в качестве фона Вот шаги со всеми сочными деталями: Шаг 1: Начните с чистого холста, чтобы сделать свои собственные обои
Что отличает их от других экзотических видов?
Свободное радикальное посвящение: почему требуется «свет» или «жар»?
Давайте рассмотрим второй из этих трех пунктов - какие типы материалов могут блокировать попадание фотонов света к нам?
Могу ли я использовать числовые свойства, такие как коэффициенты и множители?
И можно ли использовать наиболее распространенные общие факторы, наименее общие факторы и / или свойство распределения для перезаписи числовых выражений?
Могу ли я использовать правила экспонент с числовыми выражениями, с рациональными показателями для написания эквивалентных выражений, с рациональными показателями?
Какие ключевые слова, слоганы, типы контента и отдельные продукты вызвали наибольшее количество трафика в интернет-магазине или привлекли людей к фиксированной точке продаж?
Как бы вы сделали первые несколько химических элементов?
Как бы вы сделали первые несколько химических элементов?
Хотите поразить ваше устройство связи?
 МОЯ ТВОРЧЕСКАЯ ЛАБОРАТОРИЯ
МОЯ ТВОРЧЕСКАЯ ЛАБОРАТОРИЯ