Кислород и сера являются химическими элементами, относящимися к 16-й группе периодической таблицы. По старой номенклатуре: VIA. Эта группа от имени первого элемента называется аэробикой. Помимо кислорода и серы, упомянутых выше, он также включает селен (Se), теллур (Te) и полоний (Po). все аэробный он характеризуется электронной конфигурацией ns2 np4.
OXYGEN
Кислород - это химический элемент, открытый в 1774 году Дж. Пристли. Он получал кислород в результате разложения оксида ртути (II) (HgO). Почти в то же время кислород был получен другим ученым: К. В. Шееле. Однако оба не узнали его как отдельный химический элемент, а только как часть воздуха. Только французский ученый - Лавуазье несколько лет спустя в ходе исследования заявил, что это отдельный элемент. Затем он выдвинул несправедливое предположение, что кислород является компонентом всех кислот.
Латинское название кислорода - оксигениум. Как уже упоминалось выше, кислород запускает группу элементов, называемых аэробами. Его атомная масса составляет 15,9994 г / моль. Атомное число кислорода равно 8. Это означает, что кислород имеет 8 протонов и 8 нейтронов, которые являются частью атомного ядра. Вокруг электрически нейтрального ядра есть 8 электронов, 6 из которых валентные электроны.
В природе в свободном состоянии кислород встречается в двух аллотропных формах: в форме двухатомных молекул и трехатомных молекул (озон).
Молекулярный двухатомный кислород - это кислород, который встречается в нижних слоях атмосферы. Это важное вещество для живых организмов. Благодаря этому можно осуществлять процесс клеточного дыхания. Это газ, который мало растворим в воде, бесцветный, без вкуса и запаха. Это сжиженная синяя жидкость. Он не проводит тепло или электричество. Его плотность составляет 1,429 г / дм3 (он тяжелее воздуха). Температура плавления для кислорода составляет - 218 ºC, а температура испарения - 182 ºC. Показывает парамагнитные свойства. Природный кислород представляет собой смесь двух стабильных изотопов: кислорода 16O и кислорода 18O.
озон это также называют триоксидом или тритиленом. Это происходит в больших количествах в верхних слоях атмосферы - стратосфере, которая находится на высоте около 11-30 км над землей. Этот слой иначе называют озоносферой. Он создается в результате электрических разрядов. Часто после шторма вы можете почувствовать характерный запах от озона. Это также получено в результате фотохимических реакций. В этих процессах двухатомные молекулы кислорода сначала разбиваются на атомы, которые затем соединяются с другими двухатомными молекулами.
O2 → 2 O
O2 + O → O3
Озон обладает особыми свойствами - он может поглощать ультрафиолетовое излучение, под воздействием которого он распадается:
O3 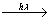 O + O2
O + O2
Благодаря постоянному возникновению реакции синтеза и разложения озона, лин должен защищать жизнь на Земле от вредного ультрафиолетового излучения, которое вызывает мутации (изменяет ДНК) и даже гибель организмов, поскольку оно расщепляет молекулы белка. К сожалению, этому драгоценному озоновому слою угрожают загрязнение окружающей среды и выбросы веществ в промышленности. Некоторые из них вызывают ускоренное разложение озона, тем самым лишая этот слой атмосферы его защитной функции. Вещества, особенно опасные для озона, включены ХФУ и оксид азота (II).
Молекула озона имеет плоскую угловатую структуру (угол, образованный между связями, составляет около 122 °). Его электронная структура называется резонансным гибридом. Озон относится к веществам, характеризующимся одним из самых сильных окислительных свойств. По этой причине его используют в качестве отбеливающего средства и для дезинфекции.
Кислород относится к наиболее распространенным элементам на планете. Его процентное содержание в литосфере (самой внешней части земного шара) и в атмосфере достигает 48,6%. Содержание кислорода в воздухе составляет около 21%. В дополнение к тому факту, что кислорода в изобилии в свободной форме, он также содержится в связанной форме: вода (составляет 89% массы воды) и во многих минералах, в основном в силикатах, алюмосиликатах, кремнеземах и карбонатных породах, которые строят земную кору. Не забывайте, что кислород относится к так называемым макроэлементы, т.е. элементные элементы, которые строят живые организмы.
Кислород относится к сильно электроотрицательным элементам и очень реактивен. Реагирует почти со всеми химическими элементами, но с большинством только при повышенных температурах. Реакции сочетания кислорода с другими веществами называются окислением, тогда как, если эта реакция происходит быстро с выделением энергии, это говорит о процессе сгорания. Кислород в химических соединениях находится в степени окисления -II. Исключение составляют пероксиды, в которых он находится по степени окисления, и фторид кислорода - здесь + II.
Лабораторный кислород легче всего получить термическим разложением перманганата калия (KMnO4) или разложением оксида ртути (II). Следующие химические уравнения иллюстрируют этот процесс:
2 KMnO4 → MnO2 + K2MnO4 + O2 ↑
2 HgO → 2 Hg + O2 ↑
В промышленных масштабах кислород получают из воздуха. Так называемый фракционная перегонка. Предварительно очищенный воздух затем конденсируется при температуре -192 [ºC]. в так называемом Камера Линде. На следующем этапе газы медленно нагреваются и, используя тот факт, что различные газы конденсируются при разных температурах, отдельные газовые фракции отделяются от сжиженного воздуха.
Оксиды являются наиболее популярными соединениями кислорода. В них кислород связан только с атомом (ами) другого элемента.
Согласно правильному, систематическому названию химических соединений, оксиды называются следующим образом: сначала дается слово оксид, а затем в родительном падеже название элемента, из которого образуется оксид. Наконец, в круглых скобках определяется валентность элемента, включая оксид. Этот номер написан римскими цифрами. Не следует давать, если данный элемент образует соединения только в одной степени окисления. Например:
- CaO - оксид кальция
- Al2O3 - оксид алюминия
- SO2 - оксид серы (IV)
- N2O5 - оксид азота (V)
- CrO3 - оксид хрома (VI)
В зависимости от валентности элемента в данном оксиде они имеют следующую химическую формулу:
Общая формула оксида
Пример оксида
Валентность элемента в оксиде
Систематическое название оксида
X2O
Na 2 O
и
Окись натрия
XO
MgO,
II
Оксид магния
X2O3
Al2O3,
III
оксид алюминия
XO2
СО2
IV
Угарный газ (IV)
X2O5
N2O5
В
Оксид азота (V)
XO3
SO3
VI
Оксид серы (VI)
X2O7
Mn2O7
VII
Оксид марганца (VII)
Оксиды по своей химической природе можно разделить на несколько групп:
- кислотные оксиды - реагируют с основаниями и не реагируют с кислотами. Те, которые растворяются в воде, образуют кислоты, а их водные растворы являются кислыми.
Например, SO2 - оксид серы (VI)
SO2 + H2O → H2SO3
SO2 + HCl → нет реакции
SO2 + 2 NaOH → Na2SO3 + H2O
Другие популярные оксиды кислот: CO 2 , P 4 O 10 , N 2 O 3 , CrO 3 , Mn 2 O 7 , NO 2 , N 2 O 5 , SO 2 , SO 3
- основные оксиды - реагируют с кислотами и не реагируют с основаниями. Те, которые растворяются в воде, образуют гидроксиды, а их водные растворы являются щелочными.
Например, K2O - оксид калия
K2O + H2O → 2 KOH
K2O + 2 HCl → 2 KCl + H2O
K2O + NaOH → нет реакции
Другие основные оксиды: MnO, CrO и все оксиды щелочи и бериллия (за исключением Be).
- амфотерные оксиды - реагируют как с кислотами, так и с основаниями. Они обычно не реагируют с водой, поэтому их водные растворы инертны.
Например, Al2O3 - оксид алюминия
Al2O3 + H2O → нет реакции
Al2O3 + 6 HCl → 2 AlCl3 + 3 H2O
Al2O3 + 2 NaOH + 3 H2O → 2 Na [Al (OH) 4]
Среди амфотерных оксидов можно выделить: ZnO, CuO, MnO2, Al2O3, As2O3, As2O5, PbO, SnO, SnO2, Sb2O3, Sb2O5.
- нейтральные оксиды не вступают в реакцию с водой, кислотами или основаниями.
Например, NO - окись углерода (II)
NO + H2O → нет реакции
NO + HCl → нет реакции
NO + NaOH → нет реакции
Существует небольшое количество нейтральных оксидов, другие: NO, CO и N2O.
вода
Вода является наиболее важным химическим соединением, существующим на Земле, поэтому она была кратко охарактеризована здесь. Другие кислородсодержащие соединения здесь опущены, потому что их огромное количество, и нет смысла упоминать их здесь.
Вода считалась одним из химических элементов на протяжении веков. В древности их было четыре: вода, огонь , земля и воздух. В наше время, когда химию считали научной дисциплиной, идея о том, что вода является химическим элементом, также поддерживалась в начале. Предложение было изменено только в 1783 году, когда А. Лавуазье произвел распределение воды по кислороду и водороду. Ему также удалось выполнить обратную реакцию: он получил воду в результате сгорания водорода в воздухе.
Как все прекрасно знают, вода в стандартных условиях представляет собой бесцветную жидкость, лишенную запаха и вкуса. Охлаждается при 0ºC и испаряется при 100ºC. Его плотность составляет примерно 1 г / см3 (точно 0,9998 г / см3). Это меняется в зависимости от температуры. Показывает самую высокую плотность при 3,98 ºC.
Молекула воды имеет угловую структуру. Атом кислорода в воде характеризуется гибридизацией sp3. Следовательно, угол между связями составляет около 109 °. Только в газообразном состоянии можно различить отдельные молекулы воды. В жидком состоянии они становятся связанными, то есть соединением, посредством водородных связей. Это чрезвычайно важная особенность, которая определяет, что вода комнатной температуры образуется в виде жидкости. Небольшое количество молекул воды претерпевает электролитическую диссоциацию:
2 H2O 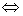 H3O + + OH-
H3O + + OH-
Вода устойчива к высоким температурам. Только при 2000ºC он разлагается на водород и кислород.
Вода является довольно реактивным веществом. При комнатной температуре он легко реагирует с литилами и бериллием с выделением молекулярного водорода. Продуктом этой реакции является подходящий гидроксид металла. Они также легко реагируют с оксидами неметаллов, давая кислородные кислоты.
Часто вода катализатор - ускоряет течение некоторых реакций.
Это является причиной коррозии металла, то есть разрушения металлов под воздействием влаги и кислорода.
В природе вода постоянно циркулирует. Я нахожусь в жидкой форме в морях, океанах, реках и озерах; в виде водяного пара в атмосфере и в виде твердого вещества, то есть льда - в основном в Антарктике и Арктике. Постоянное испарение жидкостей, таяние ледников и атмосферных осадков превращают воду в непрерывный замкнутый цикл.
Для химии вода является основным реагентом, главным образом благодаря своим растворяющим свойствам огромного числа соединений, особенно тех, которые содержат ионные или ковалентные связи, сильно поляризованные. Именно благодаря этому могут происходить диссоциация и гидролиз, а также электролиз водных растворов.
В связи с темой о воде стоит упомянуть дистиллированную и тяжелую воду.
Термин тяжелая вода определяется как вода, в которой вместо атомов водорода 1Н присутствуют атомы тяжелого водорода, так называемые 2D дейтерий, который является его изотопным сортом. Мы различаем D2O, в котором оба атома водорода заменены на дейтерий и DHO, где заменен только один атом водорода.
Естественно, это происходит в традиционной воде, являясь следом ее примеси. Для получения чистой тяжелой воды проводят многократный и продолжительный электролиз. Научно доказано, что они оказывают неблагоприятное воздействие на живые организмы. Он используется в ядерной технологии для замедления быстрых нейтронов.
Дистиллированная вода - это вода, специально очищенная от растворенных в ней природных солей. Процесс дистилляции проводится для нужд химических лабораторий. Не рекомендуется к употреблению, так как лишенный электролита вреден для человека.
СЕРЫ
Сера - это неметаллическое вещество, известное еще в древности. Затем его использовали для отбеливания тканей и для лечения кожных заболеваний. Серу часто считали магическим веществом. Свидетельством тому является его средневековое название: «стихия огня». Официально элементы были подсчитаны А. Лавуазье в 1777 году.
Латинское название для серы - сера.
Он относится к химическим элементам, расположенным в 16-й группе периодической таблицы (ранее VIA), то есть в группе, называемой аэробами. Его атомная масса составляет 32,066 г / моль. Это называется средняя атомная масса. Природная сера состоит из нескольких ее изотопов. Наиболее частыми и стабильными изотопами являются четыре: 32S, 33S, 34S и 36S. Атомное число серы равно 16. Это означает, что сера имеет 16 протонов и 16 нейтронов, которые являются частью атомного ядра. Вокруг электрически нейтрального ядра 16 электронов, 6 из которых так называемые валентные электроны.
Сера классифицируется как типичные неметаллические элементы, поэтому она не проводит электричество или тепло. Для металлов отсутствует характерный глянец.
В природе это встречается в нескольких аллотропных разновидностях (аллотропия - это встречаемость одного и того же элемента в различных формах, отличающихся структурой кристаллической решетки).
Среди аллотропных форм серы известны две кристаллические формы: ромбическая сера (Sα) и моноклинная сера (Sβ).
Ромбическая сера состоит из восьмиатомных кольцевых частиц. Это происходит в форме желтых кристаллов, которые нерастворимы в воде, редко растворимы в бензине и спирте, но очень хорошо в сульфиде углерода (CS2). Плотность серы определяется до 2,07 г / см3. Среди других видов серы можно выделить: серу желтого цвета, катод-гранулятор, пластичную серу и пары серы. Индивидуальные персонажи превращаются в больше разновидностей под воздействием температуры. В стандартных условиях алмазная сера считается стабильной формой серы. Среди пар серы имеются восьмиатомные, четырехатомные частицы, а при более высоких температурах (около 1700 ° С) также двухатомные и одноатомные частицы. При быстром охлаждении серных пар, так называемые Сульфатный цветок. Это порошкообразное желто-серое твердое вещество.
Sα (ромбическая сера)  Sβ (моноклинная сера)
Sβ (моноклинная сера)  Solta
Solta 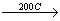 Skaten-полисульфида
Skaten-полисульфида  Splastyczna
Splastyczna  Spary
Spary
Сера - очень распространенный элемент во вселенной, она находится на 10 месте. Чуть меньше на земле, это всего лишь 0,048% от веса литосферы, которая занимает 16-е место по распространенности. На земле есть подземные залежи элементарной серы (другими словами: самородная), из которой она добывается в промышленных масштабах. В Польше такие месторождения расположены, среди прочего в Тарнобжеге. Кроме того, сера присутствует в связанной форме, образуя такие минералы, как диафрагма цинка (ZnS), пирит (FeS2) и галенит (PBS),. Наиболее важные сульфатные минералы включают в себя: гипс (CaSO4∙2H2O) и его безводную форму, т.е. ангидрит (CaSO4) и мирабилит (Na2SO4) 10H2O). Растворимые сульфатные соли также содержатся в морской воде в виде сульфат-ионов. В газообразном состоянии это компонент, который загрязняет природный газ (H2S), а сероводород и оксид серы (IV) являются основным компонентом вулканических газов. Это может также быть найдено в органических соединениях (это строит несколько аминокислот), это загрязнение нефти и природного газа (как сероводород).
Существует три основных метода промышленного производства серы:
Первый метод - это открытый метод. Он заключается в удалении верхнего слоя почвы и отборе серных руд, которые обычно содержат около 18-30% серы. Такая колея раздавлена, а потом у них так называемые мельницы. мокрый метод. Следующим этапом является обогащение этих руд путем флотации (это метод отделения металлических руд от месторождения с использованием явления различного смачивания руд и металлов нефтью и водой). Конечной стадией является фильтрация полученного концентрата через фильтры при температуре около 145 ° С. Для этого используются специальные фильтры, так называемые Келл фильтры. После фильтрации получают продукт, содержащий около 99,9% серы и остаток серы, который содержит около 40% серы. Кек используется в производстве серной кислоты. Однако чистая сера хранится в гранулированном виде или блоках. Это может также быть транспортировано в жидкой форме. Специальные цистерны служат этой цели. Этот метод извлечения серы часто используется в Польше, потому что наши родные месторождения расположены довольно мелко. Если я нахожусь глубже, используется другой метод, называемый методом Frash. Он предполагает использование трех концентрических труб, которые размещаются в скважине, достигая месторождения серы. В пространство между наружной и центральной трубами впрыскивается пар горячей воды (при температуре около 165–180 ° С и давлении 1,5–2 МПа), что заставляет серу плавиться под землей (сера плавится при 112 ° С). С другой стороны, воздух под давлением нагнетается во внутреннюю трубку, которая вытесняет жидкую серу вверх через пространство между внутренней трубкой и средней трубой. В верхней части растения выливается сера, которая затвердевает в виде желтой смолистой массы с чистотой около 99%. При этом способе получается намного более чистый продукт, чем при получении серы методом открытого литья. Недостатком является то, что можно извлечь только 20-25% от всего депозита. В основном используется в США. Последний метод называется Метод Клауса - включает каталитическое, двухстадийное окисление сероводорода, которое получается при очистке природного газа или других очищающих газов. Его ход представлен уравнением химической реакции.
2 H2S + 3 O2 → 2 SO2 + 2 H2O
2 H2S + SO2 → 3 S + 2 H2O
В процессе осуществляется в т.н. Печи Клауса используются в качестве катализатора боксит ,
Сера Образует много различных химических соединений, как неорганических, так и органических. Ниже приведены наиболее важные из них, составляющие основу для приема других.
Очень важной группой соединений серы являются ее связи с кислородом. Основные соединения серы с кислородом включают оксид серы (IV) и оксид серы (VI).
Оксид серы (IV), обычно называемый диоксидом серы, представляет собой соединение, образующееся при сгорании серы в кислороде. Эта реакция происходит согласно химическому уравнению:
S + O2 → SO2
Этот оксид также образуется в качестве побочного продукта реакции концентрированной серной кислоты (VI) с металлами:
Cu + 2 H2SO4 → SO2 + CuSO4 + 2 H2O
А в результате разложения солей: сульфаты (IV) под воздействием сильных кислот:
HCl + Na2SO3 → 2 Na Cl + SO2 + H2O
Диоксид серы - бесцветный ядовитый газ с неприятным запахом. Жидкий оксид серы (IV) является очень хорошим растворителем для многих органических и неорганических соединений. Обладает восстановительными свойствами, которые используются в химическом анализе.
Диоксид серы - это газ, который образуется в качестве побочного продукта сгорания топлива, поскольку большие количества серы загрязняют популярное ископаемое топливо, такое как нефть, природный газ или каменный уголь. Поступление большого количества этого газа в атмосферу опасно для окружающей среды, поскольку он вступает в реакцию с водяным паром, содержащимся в воздухе, и падает на землю с дождем в виде серной кислоты (IV), отсюда и частый термин «кислотный дождь».
Диоксид серы - это ангидрид дибротической слабой серной кислоты (IV):
SO2 + H2O → H2SO3
Эта кислота подвергается двухстадийной диссоциации и образует две серии солей: сульфаты (IV), содержащие сульфат-анион (IV) - SO32- и бисульфит (IV), которые содержат гидросульфат-анионы (IV) - HSO3-.
Сульфаты (IV) представляют собой соли, которые обычно плохо растворимы в воде, легко гидролизуются (анионны) и разлагаются на оксид серы (IV). В свою очередь, бисульфаты (IV) хорошо растворимы в воде. Соли серной кислоты (IV), подобно оксиду серы (IV), обладают восстановительными свойствами и легко окисляются до сульфатов (VI).
Они используются в текстильной промышленности (отбеливающие вещества) и в пищевой промышленности как консерванты ,
Вторым оксидом серы является оксид серы (VI), обычно называемый триоксидом серы - SO3. Образуется в результате каталитического окисления оксида серы (IV).
2 SO2 + O2 → 2 SO3
Этот оксид представляет собой твердое тело, напоминающее лед при нормальных условиях. Это чрезвычайно реактивное химическое соединение, быстро соединяющееся с водой с образованием сильной, микробной серной кислоты (VI) с окислительными свойствами H2SO4.
H2O + SO3 → H2SO4
Растворенный оксид серы (VI) в насыщенной концентрированной серной кислоте (VI) называется олеумом.
Оксид серы (VI) и его кислота обладают гигроскопическими свойствами - они поглощают влагу, его используют при производстве дегидратирующих агентов.
Серная кислота (VI) является одной из самых сильных существующих кислот, она может даже переваривать драгоценные металлы при повышенной температуре, в то время как концентрированные органические вещества обугливаются. Однако, в отличие от азотной кислоты (V), разбавитель больше не обладает окислительными свойствами.
Он используется для производства взрывчатых веществ, обезвоживающих веществ, искусственных удобрений и рафинирования жиров.
В промышленном масштабе так называемые контактным методом из общедоступного минерала FeS2 сульфид железа. Производственная диаграмма была представлена с использованием ряда уравнений:
4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
2 SO2 + O2 → 2 SO3
H2O + SO3 → H2SO4
Помимо серных кислот, описанных выше, существуют и другие, например, пероксосерные кислоты, которые образуются путем объединения двух молекул серной кислоты с кислородным мостиком (например, H2S2O8 - пероксосульфокислота) или кислоты, молекулы которых образуются путем замещения атомов кислорода в молекуле серной кислоты, атомы серы (например, H2S2O3 - тиосерная кислота)
Сера легко соединяется с галогенами, образуя с ними галогениды. В галогенидах сера может быть найдена на различных уровнях окисления. Примеры:
-фториды: S2F2, S2F10, SF2, SF4
- хлориды: SCl4, SCl2, S8Cl2
- бромиды: S2Br2
Сера также легко соединяется с водородом, образуя с ним сульфон, который иначе называют сероводородом. Это может быть легко получено прямым синтезом элементов:
H2 + S → H2S
Он также развивается при воздействии неокисляющих кислот на сульфиды металлов. Ex.:
PbS + 2 HCl → PbCl2 + H2S
Сероводород представляет собой бесцветный легковоспламеняющийся газ с резким удушливым запахом (часто называемый запахом тухлых яиц, поскольку он образуется в разбитых яйцах в процессе анаэробной деградации белка). Это высокотоксичное вещество. Очень слабо растворяется в воде, образуя слабую биотонную сероводородную кислоту.
Сероводородные соли являются сульфидами. Сульфиды щелочных металлов, сульфид бериллия и аммония относятся к солям, которые растворимы в воде, в то время как сульфиды металлов блока d не растворяются в воде. Все растворимые соли сероводородной кислоты подвергаются щелочному (анионному) гидролизу в воде. Тот факт, что большинство сульфидов не растворяется, а их осаждение из растворов в виде цветных отложений было использовано при химическом анализе качества (сероводородная кислота является групповым реагентом).
Сульфиды используются при производстве красителей (в основном, красок), при изготовлении спичек и в косметике, в которых сера является субстратом при производстве депиляторов.
Похожие
RP Фотоника ЭнциклопедияВ большинстве случаев лазер излучает свет в виде лазерного луча. Это означает, что свет преимущественно распространяется в определенном направлении, как правило, с большей частью оптическая сила сосредоточены на небольшой площади порядка квадратного миллиметра. Лазерные лучи часто близки к Гауссовы ... характеристика цитрусовых Четыре секвенированных вида из этого исследования (аталантия, папеда, цитрон...
... характеристика цитрусовых Четыре секвенированных вида из этого исследования (аталантия, папеда, цитрон и пуммело) и два ранее опубликованных секвенированных вида (сладкий апельсин и мандарин клементина) 18 , 19 варьируются от примитивных до культивируемых цитрусовых ( рисунок 1 ). Обзор синтении генома и вариации последовательности представлен Климат города - базовый уровень: причины антропогенного загрязнения воздуха
Большинство антропогенных загрязнителей воздуха попадают в атмосферу в результате сжигания ископаемого топлива на теплоэлектростанциях, в промышленном производстве и на транспорте. Однако в развитых странах и городах загрязнение дорожного движения играет важную роль. Источники антропогенного загрязнения воздуха Основным процессом, в ходе которого происходит выброс загрязняющих веществ в атмосферу, является сжигание ископаемого топлива на электростанциях, Полиэмбрионы в неапомиктичных цитрусовых генотипах
Аннотация История вопроса и цели Случайный эмбрион из клеток nucellar является механизмом, приводящим к апомиксису у Citrus sp. Тем не менее, единичные случаи полиэмбрионии были зарегистрированы в неапомиктичных генотипах вследствие 2х × 4х гибридизации и культивирования in vitro изолированных ядер. Происхождение растений в результате вышеупомянутых процессов остается неясным. методы Генетическая структура (плоидность и аллельное
 МОЯ ТВОРЧЕСКАЯ ЛАБОРАТОРИЯ
МОЯ ТВОРЧЕСКАЯ ЛАБОРАТОРИЯ