- Квантовые свойства электромагнитного излучения.
- Принцип неопределенности Гейзенберга.
В конце девятнадцатого века физика, казалось, была насыщена недавно открытыми законами, управляющими природой и всей Вселенной. Исследователи не ожидали больших новинок в своей области. Однако уже в 1900-е годы и лето принесли много удивительных и даже феноменальных открытий. Они положили начало созданию и бурному развитию нового направления - квантовой физики. Его начало - дата 14 декабря 1900 года, когда Макс Планк предположил, что энергия света не является непрерывной, а отправляется и поглощается небольшими порциями. Эти части были названы квантами. Принимая во внимание это свойство, Планк отметил, что энергия излучения черного тела не может быть произвольной, но должна быть выражена в виде кратного кванта энергии. Это свойство было названо квантовым.
Макс Планк описал формулу для квантовой энергии электромагнитного излучения:
E = h ∙ V,
где:
V - частота излучения
h - постоянная Планка = 6,62 ∙ 10-34 Дж ∙ с
И затем, используя квантовую гипотезу, он вывел формулу в спектральную мощность излучения черного тела:
Rλ = (2 ∙ π ∙ c2 ∙ h) / [λ5 ∙ (eh ∙ c / k ∙ λ ∙ T-1)],
где:
h- постоянная Планка
k - постоянная Больцмана
с - скорость света
Т - температура по абсолютной шкале
2. Право венских переводов.
Этот закон был сформулирован на основе опыта Вильгельма Вены в 1893 году. Он касается электромагнитного излучения, испускаемого совершенно черным телом. Вин заявил в нем, что повышение температуры черного тела сопровождается смещением спектра его излучения в сторону более коротких длин волн. Этот сдвиг называется смещением вены и выражается следующей формулой:
Λmax = b / T
Λmax - длина волны с наибольшей интенсивностью излучения
B-Этап Wiena со значением 2,8977685 ∙ 10-3 +/- 5,1 ∙ 10-9 м ∙ K
Т - температура черного тела
Сдвиг Звезды наблюдается как изменение цвета излучаемого излучения. Например: принять во внимание черное тело, например, железный шар, и подвергать его воздействию более высоких и более высоких температур. Вот что мы увидим: сначала шар не будет излучать свет, при температуре около 8000 К он будет светиться цветом тепла - темно-красным, после очередного повышения температуры шар меняет цвет с оранжевого на желтый и фиолетовый. Если мы возьмем призму, чтобы помочь, мы заметим, что шар также излучает две волны, невидимые невооруженным глазом. Перед темно-красной инфракрасной волной и за ультрафиолетовой фиолетовой волной.
Явление сдвигов Вено является отличным инструментом для изучения температуры, например, звезд, если предположить, что мы относимся к абсолютно черным телам.
Закон Вены был сформулирован раньше, чем так называемый Распределение Планка (разница 7 лет), но рассматривается как вывод из этого распределения.
3. Фотоэлектрический эффект (фотоэмиссия электронов).
Внешний фотоэлектрический эффект заключается в отрыве электронов от поверхности твердого тела под воздействием падающего излучения. Это явление зависит от типа вещества, на которое падает излучение, и его частоты. Испускаемые электроны называются фотоэлектронами. Наилучшие эффекты достигаются излучением короткой волны (то есть высокой частоты), направленной на металл. Первым ученым, который математически объяснил это явление, был Альберт Эйнштейн, за который он был удостоен Нобелевской премии в 1921 году. Эйнштейн согласился в соответствии с теорией Планка, что излучение, падающее на данный металл, например, является квантовофотонами с энергией E = h ∙ V каждый. Он также заявил, что энергия падающих фотонов преобразуется не только в кинетическую энергию (ускорение) электронов, испускаемых из металла, но и в так называемые начинаю работу. Это работа, выполненная над электронами, все еще находящимися в металле - необходимо вырвать их из его поверхности. Работа выхода напрямую зависит от типа вещества, участвующего в явлении. Вот почему легче уничтожить электроны из одних веществ, а другим - труднее. Формула Альберта Эйнштейна, объясняющая внешний фотоэлектрический эффект, выглядит следующим образом:
h ∙ V = W + Ek,
г день:
h - постоянная Планка (как указано выше)
V - частота волны излучения
Начало работы
Ek - кинетическая энергия электронов, высвобождаемых из металла.
В дополнение к внешнему фотоэлектрическому эффекту существует также внутренний фотоэлектрический эффект . Это происходит в полупроводниках и заключается в том, что: когда мы облучаем полупроводник электромагнитным излучением соответствующей частоты, это вызывает перенос носителей электрического заряда в проводнике (свободных электронов или так называемых «дырок») на более высокий энергетический уровень. Результатом является увеличение проводимости в полупроводнике.
2. Волны де Бройля - материальные волны.
Основой для открытия волн де Бройля стала гипотеза, основанная в 1900 году М. Планком на корпускулярно-волновой (молекулярно-волновой) структуре электромагнитного излучения (то есть, что свет можно рассматривать как волну и как вещество, построенное из так называемых частиц). . фотоны). В 1924 году ученый Луи де Бройль, исходя из теоретических соображений, заявил, что это двойная конструкция материи. Расширяя свои предсказания, Бройгл предположил, что длина предсказуемых волн, испускаемых частицами вещества (с ненулевым импульсом), должна определяться соединением, называемым формулой де Бройля:
λ = ч / р,
где:
λ - длина волны вещества
h - постоянная Планка
р - импульс частицы вещества.
Аналогично, согласно волновой теории, каждой энергетической частице E может быть назначена другая характеристика ее размера - частота υ:
f = E / ч.
Великая гипотеза Л. де Бройля встретила большой интерес и поддержку. В 1927 году это было подтверждено экспериментально (проверяется, испытывают ли волны вещества аналогичные дифракционные явления и помехи), а в 1929 году его первооткрывателю была присуждена Нобелевская премия.
Этот принцип был сформулирован Вернером Гейзенбергом в 1927 году и является очень важной теорией квантовой физики. Это относится и к корпускулярно - волновой структуре вещества. Принцип неопределенности говорит о том, что даже с самой большой точностью импульс и положение данной частицы не могут быть определены одновременно.
Если мы принимаем знаки:
Δx - неопределенность измерения положения
Δp - неопределенное измерение импульса
h - постоянная Планка,
ħ - постоянная Дирака со значением h / 2
это принцип неопределенности Гейзенберга, который мы можем определить с помощью формулы:
Δx ∙ Δp ≥ h / (4 ∙ π) = ħ / 2
В 1945 году Леонид Мандельштам и Игорь Тамма обосновали, что принцип неопределенности Гейзенберга также применим к энергии частиц (и точно к энергии волны Бройля) и времени ее жизни:
ΔE ∙ Δt ≥ħ
Важно то, что принцип неопределенности применяется не только в микромире, но и в макромире. Неопределенность измерения, проводимого в микромире, может быть связана с ошибкой измерения. И это значение не ошибка, а оценка «площади» наиболее вероятных результатов измерений. И независимо от того, проводится ли измерение с использованием очень точных инструментов или подвергается определенной ошибке измерения. В окружающем макромире неопределенность измерений менее важна из-за того, что небольшие колебания в результатах «умирают» по сравнению с масштабом самого результата.
2. Уравнение Шредингера и его применение.
Открытие волн де Бройля положило начало развитию квантовой физики. Эрвин Шредингер, используя формулы, используемые Планком и Бройлем для определения частоты υ и длины волны вещества λ : ν = E / h, λ = h / p (где: p - импульс частицы, h - постоянная Планка), определил общую энергию частицы:
E = p2 / 2mo + V,
где:
частица р,
m0 - масса покоя частицы
V - потенциальная энергия частицы
Он также подумал о том, что если мы будем рассматривать электрон как волну, невозможно будет точно определить место, где находится эта частица. Шредингер пришел к выводу, что единственное, что вы можете сделать, - это рассчитать вероятность того, что данный электрон окажется в принятой точке. С этой целью он сформулировал знаменитое уравнение, так называемый Уравнение Шредингера . Он выражает движение частицы под действием силы, действующей на нее (электромагнитной, гравитационной и т. Д.) Со скоростью, значительно меньшей скорости света. Эта частица может быть либо электроном, либо любой другой частицей известной нам массы. Решение уравнения Шредингера (это дифференциальное уравнение) для конкретной частицы определяет, из каких волн она может быть источником. Это решение называется так называемым волновая функция, она зависит от времени и положения и помечается как: Ψ (x, y, z, t).
Общая форма уравнения Шредингера довольно сложна и выглядит следующим образом:
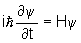
где:
и - мнимая единица,
ħ = h / 2π - постоянная Дирака
(ч - постоянная Планка),
t - время,
H - гамильтонова система
wave - волновая функция, описывающая эту систему.
Квадрат модуля (абсолютное значение) значения волновой функции ψ определяет плотность вероятности нахождения частицы в данном месте (пропорционально значению). Следует также помнить, что неопределенность положения частицы в данном месте не может быть меньше, чем определено принципом неопределенности Гейзенберга.
2. Принцип Паули и периодическая таблица элементов.
Запрет Паули - это закон, сформулированный Вольфгангом Паули в 1925 году, который является его заключением о наблюдении атомных спектров отдельных элементов. Запрет Поли говорит о том, что любые два электрона в атоме не могут находиться в одном и том же квантовом состоянии, т.е. квантовое число Введя этот запрет, Паули объяснил причины удивительной регулярности в атомных спектрах. Это также стало основой для открытия многих других закономерностей в химии и физике. Одной из наиболее известных и, вероятно, наиболее важных является зависимость структуры электронов в атомах от физических и химических свойств элементов. Что это значит? Как мы знаем, электроны вращаются вокруг ядра атома после нескольких орбит (с различной степенью энергии). Запрет Паулы не допускает более двух электронов на одной орбите с одинаковым спином (моментом импульса). Благодаря этому электроны выводятся на орбиты в соответствии с принципом - после заполнения первой орбиты в соответствии с запретом Паули следующие электроны переходят на вторую, и снова только после заполнения ею третьей и т. Д. Благодаря этому мы имеем огромное разнообразие элементов. Потому что, если бы у всех из них электроны были упакованы только на первой орбите, мы имели бы дело только с идеальными газами, и не было бы никакой возможности химических изменений. Запрет Паули - это основной закон, оправдывающий построение периодической системы элементов, поскольку он очень четко определяет структуру орбит в атомах, число циркулирующих на них электронов, что, в свою очередь, позволяет точно классифицировать, из какого элемента происходит атом.
Периодическая таблица элементов.
Периодическая таблица элементов является таблицей представления соседство все элементы, расположенные по возрастанию атомного номера (число электронов в свободном атоме или протоны в атомном ядре), а также сгруппированные в зависимости от физико-химических свойств. Такое графическое расположение элементов позволяет очень легко и быстро различать их свойства в зависимости от положения в системе. Таблица периодической таблицы (согласно Вернеру) состоит из семи строк, называемых периодами, и восемнадцати столбцов, называемых группами. (Недавние исследования периодической таблицы уже насчитали 8 или даже 9 периодов). Группы содержат элементы с одинаковым числом электронов на внешних / валентных оболочках и делят их на: основные (нумерация с римскими цифрами от I до VIII) и второстепенные (в которых две группы лантаноидов и актиноидов разделены графически). Однако периоды нумеруются арабскими цифрами от 1 до 7, и номер периода определяет количество электронных оболочек в данном элементе. «Периодичность» в названии элементной системы проистекает из того факта, что в основных группах (проходящих горизонтально от I до VIII) каждые 8 элементов один электрон заполнен, а следующие электроны перемещаются на более высокую орбиту. Таким циклическим образом последующие орбиты создаются в атомах и, следовательно, распознаются орбиты с одинаковым числом оболочек в отдельном ряду (уровне) в системе элементов.
Расположение элементов в системе по группам позволяет наблюдать другую закономерность. Группы I и II (исключая водород) являются элементами сильных металлов. По мере продвижения к следующим группам (по горизонтали от I до VIII) мы отмечаем явное ослабление металлических свойств через переходные металлы, лантаноиды, актиноиды и металлоиды, до сильных неметаллов и, наконец, благородных газов. Это означает, что если мы рассмотрим каждую группу отдельно (в виде столбца), чем ниже элемент в ней, тем лучше металл. В случае неметалла - вместе с высотой в колонне падает «прочность» неметалла. Однако все атомы боковых групп, а также лантаноиды и актиниды являются металлами, но внутри них внутреннее деление на более сильные и более слабые не так регулярно, как в основных группах.
Самое странное, что создатель первой периодической системы элементов Дмитрий Менделеев правильно распределил все известные ему элементы, основываясь только на их атомных массах. Он опубликовал ее в 1869 году, и эта система, известная сегодня как таблица Менделеева или краткая форма периодической таблицы элементов, уже содержала более 90 элементов. Для ученого было также прекрасной идеей, что он не предполагал, что все элементы известны и что его система должна быть свободна от пробелов. Там, где он наблюдал слишком большие различия в атомных массах или химических свойствах, он оставлял пустые места. В последующие годы вновь открытые элементы идеально вписывались в систему и демонстрировали химические свойства, соответствующие местоположению в системе. В 1905 году Альфред Вернер, основанный на системе Менделеева, создал свою более длинную форму, которая до сих пор является наиболее используемой. Появление первых периодических систем элементов было в значительной степени интуитивным и наблюдательным "составлением загадок", с неизвестным появлением целого. Научным подтверждением этой «физико-химической загадки» стали такие события, как открытие Резерфордом (1911 г.) атомного ядра, таблица количества протонов и электронов в элементах (Мозли, 1913 г.), конструкция атома, объявленная Бором, и больше всего Паула Паули (1925), который объяснил происхождение химических свойств элементов.
В настоящее время периодическая таблица элементов все еще дополняется новыми. Графическая структура также была немного изменена. Международная организация IUPAC занимается утверждением новых элементов, их названий и символов.
Похожие
«Это физика» - серия физики для младших классов средней школы... физика В учебнике для средней школы "Это физика" часть 3 Содержание начинается с электростатики и электрического тока, затем включаются электричество, магнетизм, вибрации и волны. Материал представлен в простой и понятной форме, с использованием необходимого и элементарного математического аппарата. Это помогает заинтересовать предмет и эффективно преподавать физику благодаря доступному и лаконично представленному контенту, многочисленным ссылкам на интуицию Физика в нашем теле
Современная наука изучает живые организмы на уровне образующих их макромолекул, объясняет механизмы физиологии, знакомится с генетическим кодом, анализирует химические реакции. Новые области изучения междисциплинарного характера появляются все чаще и чаще, потому что сегодня невозможно узнать и объяснить необнаруженные законы природы, если они не анализируются целостным образом. А в школе? Мы по-прежнему часто преподаем отдельные предметы, рассматривая окружающий мир только сквозь призму Что это значит?
А в школе?
 МОЯ ТВОРЧЕСКАЯ ЛАБОРАТОРИЯ
МОЯ ТВОРЧЕСКАЯ ЛАБОРАТОРИЯ