Предполагается, что почти все химические реакции, происходящие в природе, являются обратимыми процессами. Это означает, что конкретные продукты формируются из конкретных субстратов, и в то же время разложение продукта на субстраты происходит в большей или меньшей степени. Чтобы однозначно определить наименование, предполагается, что субстраты всегда сохраняются в левой части уравнения реакции, а продукты - в правой. Иногда возникает проблема, как определить соединения, участвующие в реакции, идущей в противоположном направлении. Большинство обратимых реакций протекают в определенном направлении (вправо или влево) в зависимости от условий реакции. Однако следует помнить, что хотя в определенных условиях конкретное направление реакции является предпочтительным по условиям, в действительности реакция идет в обоих направлениях, но с разными скоростями. В тот момент, когда скорость реакции справа намного больше, чем скорость реакции слева, субстраты будут почти полностью превращаться в продукты, и этот процесс обычно считается практически необратимым. Однако может случиться так, что в какой-то момент скорости реакции в обоих направлениях станут равными. Затем так называемый химическое равновесие между субстратами и продуктами. Чтобы проиллюстрировать этот факт, можно рассмотреть общую химическую реакцию, в которой моли вещества A реагируют с молями вещества B с образованием молей вещества E и доз вещества D.
aA + bB = eE + dD
Скорость реакции, идущей вправо (превращение субстратов в продукты), будет описываться уравнением
v1 = k1 cAa cBb
Константа k1 является константой скорости реакции, происходящей справа. Из приведенного выше уравнения скорость v1 уменьшается во время реакции по мере уменьшения концентраций субстратов A и B. Как только появляются первые количества продуктов E и D, может происходить обратный процесс, в результате которого продукты могут подвергаться обратным реакциям ( влево) с воссозданием подложек A и B. Скорость этого процесса может быть записана следующим образом.
v2 = k2 cee cDd
Константа k2 - это постоянная скорости реакции, идущая влево. Скорость v2 будет увеличиваться во время реакции из-за накопления все большего количества продуктов E и D.
В тот момент, когда температура в системе постоянная, скорости обеих реакций зависят только от концентраций реагентов. Через некоторое время будет установлено определенное химическое равновесие, при котором скорость процессов, происходящих в обоих направлениях, будет одинаковой. Вы можете сохранить его следующим образом.
k1 cAa cBb = k2 cEe cDd
После соответствующего преобразования приведенного выше уравнения получается следующее соотношение
k1 / k2 = cee cDd / cAa cBb
При данной температуре отношение двух констант скорости реакции k1 и k2 имеет постоянную величину и называется постоянным химическим равновесием.
k1 / k2 = Kc
Для общей химической реакции стехиометрического уравнения
w1R1 + w2R2 + ... → w3R3 + w4R4 + ...
будут выполнены следующие отношения:

Постоянная Kc называется концентрационной постоянной химического равновесия. Вышеуказанная связь была открыта в 1867 году двумя химиками, Гульдбергом и Вааге, и называется законом масс или законом химического равновесия. Можно сказать, что в состоянии химического равновесия отношение произведения молярных концентраций продуктов реакции, доведенных до мощностей, равных соответствующим стехиометрическим коэффициентам, к молярным концентрациям субстратов, также поднятых до соответствующих мощностей, является постоянной характеристикой для конкретной реакции и данной температуры. Для реакции, протекающей в газовой фазе, например
3H2 + N2 = 2 NH3,
введение так называемого постоянное давление равновесия с использованием давлений отдельных реагентов.
Kp = p2NH3 / pN2 • p3H2
Следует помнить, что постоянные равновесия для некоторых частых реакций имеют свои характерные имена. Например, для реакции диссоциации константа равновесия называется константой диссоциации.
Следует, однако, рассмотреть, как будет вести себя система, выпавшая из равновесия. Поведение системы в такой момент определяется правилом, сформулированным Ле Шателье, известным как правило противоречия или правило Ле Шателье и Брауна. Следует подчеркнуть, что это правило носит общий характер и говорит о том, что если в какой-то момент нарушается состояние баланса системы, система начнет преобразование, которое будет противодействовать введенным нарушениям, что приведет к скорейшему восстановлению баланса. В случае химического равновесия возможные нарушения обычно состоят в изменении концентрации любого из компонентов, участвующих в реакции, или изменении температуры, а также изменении давления (для реакций с одновременным изменением объема). Изменения, вызванные возмущением системы, происходят до тех пор, пока процессы, происходящие в обоих направлениях, снова не станут равными. Через определенный промежуток времени мы будем наблюдать перебалансировку. Однако следует помнить, что тогда баланс будет поддерживаться при других концентрациях, чем до внесения изменений. Когда возмущение, вносимое в систему в равновесном состоянии, приводит к увеличению концентрации продуктов реакции, говорят, что баланс такой реакции смещен вправо. Когда нарушение вызывает увеличение концентрации субстрата, говорят, что баланс реакции смещен влево.
Как правило, Ле Шательера может сделать следующие выводы.
Приводя систему к равновесию дополнительных порций субстрата, это вызывает смещение реакционного равновесия вправо, что приводит к увеличению количества продуктов. Обоснуйте этот факт очень простым способом. Что ж, увеличение концентрации субстрата приводит к увеличению значения знаменателя в формуле константы равновесия. Чтобы снова получить определенное значение постоянной Kc, числитель этой доли должен быть увеличен, или знаменатель должен быть уменьшен. Оба эти процесса происходят в тот момент, когда субстраты превращаются в продукты, поэтому концентрация конечных продуктов увеличивается в конечном результате.
Введение продукта в систему в состоянии равновесия приводит к смещению равновесия влево, что, следовательно, увеличивает концентрацию субстратов в системе. Обоснование может быть представлено аналогичным образом. Увеличение концентрации продукта вызывает увеличение значения счетчика в уравнении Гульдберга и Вааге. Чтобы достичь переопределенного значения Kc, знаменатель должен быть увеличен или счетчик может быть уменьшен. Это связано с превращением продуктов обратно в субстраты.
Удаление продукта из системы в равновесии приводит к смещению баланса вправо. Это связано с тем, что удаление продуктов уменьшает значение счетчика и для того, чтобы фракция повторно применила значение Kc до возмущения, знаменатель должен быть уменьшен или счетчик увеличен. Оба эти изменения являются результатом реакции субстратов на производство продуктов.
Удаление субстратов из системы в равновесии, сдвигает баланс влево к субстратам.
Но, конечно, не только изменения концентраций отдельных веществ, участвующих в реакции, приводят к выходу системы из равновесия. Аналогичный эффект наблюдается в случае изменений температуры системы, и эффект этих изменений зависит от того, является ли данная реакция экзоэнергетической или эндоэнергетической. Нагревание системы, в которой происходит экзотермическая реакция, сдвигает баланс влево к субстратам. В случае эндоэнергетической реакции повышение температуры вызывает смещение баланса вправо, в сторону создания продуктов. Обратные эффекты наблюдаются в случае понижения температуры отдельных систем. Охлаждение системы, в которой происходит экзотермическая реакция, вызывает смещение равновесия вправо, а понижение температуры системы, в которой происходит эндоэнергетическая реакция, вызывает смещение равновесия влево к подложкам.
Кроме того, изменения давления в системе часто влияют на смещение баланса в определенном направлении. Увеличение давления вызывает смещение равновесия вправо, когда в результате реакции в газовой фазе объем реагентов уменьшается, т.е. общий объем субстратов превышает общий объем продуктов. Примером такого типа реакции является реакция синтеза аммиака из азота и водорода, происходящая по уравнению:
3H2 + N2 → 2NH3
В случае, когда общий объем субстратов данной реакции меньше, чем объем продуктов, тогда увеличение давления в системе будет способствовать протеканию реакции слева.
Аналогичным образом, можно сделать вывод, что снижение давления приведет к смещению баланса влево, когда объем подложек больше объема продуктов, и вправо, когда объем подложек меньше объема продуктов.
Введение в реакционную среду дополнительного инертного газа в газовой фазе вызывает определенный тип разбавления реагентов, в результате разбавления отдельные парциальные давления снижаются. Вот почему добавление инертного газа оказывает идентичное влияние на положение равновесия, например, снижение общего давления. Поэтому он предпочтителен для реакции разложения, хотя он неблагоприятен для реакции синтеза.
Кратко обсуждаемые выводы, вытекающие из правила Ле Шателье, хорошо показывают, как следует проводить определенную химическую реакцию для достижения максимально возможного выхода продукта. Один из субстратов может быть использован в чрезмерных количествах, один из продуктов может быть удален из системы по ходу реакции. Система должна охлаждаться, когда реакция является экзотермической, а когда реакция является эндотермической, ее следует нагревать. В случае реакций, происходящих в газовой фазе, для которых объем субстратов превышает объем продуктов, следует применять повышенное давление. Реакции, для которых объем газообразных субстратов меньше, чем объем газообразных продуктов, наиболее предпочтительно проводить при пониженном давлении.
Иногда все приведенные выше советы можно использовать одновременно, но иногда они ограничены, хотя бы по экономическим причинам.
Следует понимать, что катализаторы, очень часто используемые в различных типах реакций, никак не влияют на состояние равновесия. Это потому, что в общем подходе процесса, катализатор он реконструируется, и в результате после завершения реакции он в системе остается таким же, как и до ее начала. Это может быть записано с использованием следующего схематического общего уравнения, включая катализатор.
A + B + X → C + D + X
Формула для константы равновесия такой реакции будет следующей:
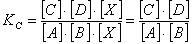
Катализатор вызывает только уменьшение энергии активации реакции и более высокую скорость ее протекания в одинаковой степени влево и вправо. Добавление катализатора в систему в равновесии не меняет положение равновесия. Это не влияет на эффективность процесса, а только увеличивает его скорость, что делает баланс более динамичным.
Что касается формы записи, чтобы подчеркнуть, что данная система отдельных реагентов находится в равновесии, знак двух перевернутых стрелок применяется один над другим в химических уравнениях. Однако следует помнить, что если бы этот знак означал только обратимость реакции, он должен был бы быть включен в каждое уравнение реакций, потому что все реакции в некотором роде являются обратимыми процессами. Если в состоянии равновесия количество продуктов намного больше количества подложек, то это можно записать в виде двух перевернутых стрелок, верхняя, направленная вправо, будет длиннее, чем нижняя, направленная влево. Противоположный случай, когда количество субстратов в равновесии намного больше, чем количество созданных продуктов. Одна стрелка, → используется, среди прочего, когда один из продуктов покидает реакционную среду, и система не достигает равновесия, когда реакция продолжается до истощения субстрата, а также с теоретическим допущением 100% эффективности процесса. Также в случае рассмотрения только процесса, происходящего в одном направлении, используется запись в виде одной стрелки.
Похожие
Как бороться со сносками и библиографией? (бесплатная электронная книга)Каждый студент, который пишет диссертацию, должен ознакомиться со сносками и подготовить библиографию. Эта задача требует исключительной точности, последовательности, а также овладения несколькими простыми и в то же время ключевыми принципами. Если подготовка сносок и библиография затрудняют вас, а промоутер отправляет вам еще одну главу для улучшения, у нас есть кое-что для вас! Английская грамматика: прошлое на английском
Увидев формирование Присутствует на английском В этом новом уроке грамматики давайте посмотрим, как прошлое выражается на английском языке. Точнее, различные прошедшие времена - потому что, как и на немецком языке, существует несколько форм. На английском языке проводится различие между Простым прошлым , Настоящим Совершенным
 МОЯ ТВОРЧЕСКАЯ ЛАБОРАТОРИЯ
МОЯ ТВОРЧЕСКАЯ ЛАБОРАТОРИЯ