 МОЯ ТВОРЧЕСКАЯ ЛАБОРАТОРИЯ
МОЯ ТВОРЧЕСКАЯ ЛАБОРАТОРИЯ
|
|
06.09.2018
СПИРТЫ
Спирты — органические вещества, производные углеводородов, которые содержат в молекулах гидроксильные группы ОН, присоединенные к атомам углерода. Так, метиловый спирт (метанол) CH3 – OH представляет собой гидроксильное производное метана CH4, этиловый спирт (этанол) CH3 – CH2 – OH — производное этана CH3 – CH3. Примеры спиртов: метиловый CH3OH, этиловый CH3CH2OH, нормальный бутиловый CH3CH2CH2CH2OH, этиленгликоль HO—CH2—CH2—OH, глицерин OHCH2—CH(OH) —CH2OH, бензиловый спирт C6H5CH2OH и т. д.
В зависимости от характера углеводородного радикала спирты могут быть алифатическими, алициклическими, ароматическими и гетероциклическими соединениями. По числу ОН-групп в молекулах различают спирты одноатомные (алкоголи), двухатомные (гликоли), трехатомные (глицерины) и другие многоатомные спирты.
Подобно молекулам воды, молекулы низших спиртов связываются между собой водородными связями. Поэтому они представляют собой ассоциированные жидкости и имеют более высокие температуры кипения, чем углеводороды, производными которых они являются, и чем другие органические вещества с таким же составом и молекулярной массой, но не содержащие гидроксильных групп.
Спирты широко распространены в природе в свободном состоянии и в виде сложных эфиров. Так, например, воски — это эфиры высших алифатических спиртов, фенилэтиловый спирт и ментол — составные части эфирных масел, цетиловый спирт найден в пчелином воске и т. д.
Низшие одноатомные спирты — бесцветные жидкости, высшие (начиная с C12) —твердые вещества. Так, спермацет, ради добычи которого ведется промысел кашалотов, содержит цетиловый спирт C16H33OH, необходимый для приготовления медицинских мазей и косметических кремов. Из пчелиного воска выделили спирты с числом атомов углерода 26 и 30. Простейшие гликоли и глицерины — вязкие жидкости. Природные жиры и масла представляют собой сложные эфиры глицерина и высших карбоновых кислот.
В спиртах между гидроксильными группами молекул образуются прочные водородные связи, поэтому спирты имеют более высокие температуры кипения, чем углеводороды с такой же молекулярной массой; они хорошо растворяют многие вещества.
В молекулах спирта кроме насыщенных могут быть и ненасыщенные связи между атомами углерода. Такую структуру имеют некоторые компоненты душистых эфирных масел. Например, главная составная часть розового масла — гераниол C10H17OH, в молекуле которого имеются две двойные связи.
Простейший спирт — метиловый CH3OH раньше называли древесным, так как он был продуктом сухой перегонки дерева.
Метиловый спирт, или метанол, CH3OH весьма ядовит. Прием небольших доз его внутрь вызывает слепоту, а больших - смерть. Теперь метиловый спирт получают в больших количествах синтезом из оксида углерода (II) СО, и водорода при высоком давлении (20 – 30МПа) и высокой температуре (400оС) в присутствии катализатора (около 90% ZnO и 10% Cr2O3);

Применяется он как растворитель, а также для получения других органических веществ.
Этиловый спирт образуется в результате брожения сахара под действием ферментов. Этот процесс известен человеку более 2000 лет и лежит в основе виноделия. Технический этиловый спирт получают гидратацией этилена по реакции: C2H4+H2O→C2H5OH.
Этиловый (винный) спирт, или этанол CH3CH2OH - одно из важнейших исходных веществ в современной промышленности органического синтеза. Для получения его издавна пользуются различными сахаристыми веществами, например виноградным сахаром, или глюкозой, которая путем «брожения», вызываемого действием ферментов (энзимов), вырабатываемых дрожжевыми грибками, превращается в этиловый спирт. Реакция протекает согласно схеме:
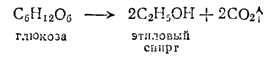
Глюкоза в свободном виде содержится, например, в виноградном соке, при брожении которого получается виноградное вино с содержанием спирта от 8 до 16%.
Исходным продуктом для получения спирта может служить полисахарид крахмал, содержащийся, например, в клубнях картофеля, зернах ржи, пшеницы, кукурузы. Для превращения в сахаристые вещества (глюкозу) крахмал предварительно подвергают гидролизу. Для этого муку или измельченный картофель заваривают горячей водой и по охлаждении добавляют солод — проросшие, а затем подсушенные и растертые с водой зерна ячменя. В солоде содержится диастаз (сложная смесь ферментов), действующий на процесс осахаривания крахмала каталитически. По окончании осахаривания к полученной жидкости прибавляют дрожжи, под действием фермента которых (зимазы) образуется спирт. Его отгоняют и затем очищают повторной перегонкой.
В настоящее время осахариванию подвергают также другой полисахарид — целлюлозу (клетчатку), образующую главную массу древесины. Для этого целлюлозу подвергают гидролизу в присутствии кислот (например, древесные опилки при 150 – 170оС обрабатывают 0,1 – 5% серной кислотой под давлением 0,7 – 1,5 МПа). Полученный таким образом продукт также содержит глюкозу и сбраживается на спирт при помощи дрожжей (гидролизный спирт).
Наконец, этиловый спирт может быть получен синтетическим путем из этилена. Суммарная реакция заключается в присоединении воды к этилену (в присутствии катализаторов):

Спирты с большим числом атомов углерода в молекуле (от 3 до 20) также получают путем химического синтеза.
Спирты — важные в практическом отношении органические вещества, они используются в производстве красителей, лаков, синтетических волокон, пластических масс, моющих средств, лекарственных препаратов и т. д.
Кроме спиртов с одной гидроксильной группой в молекуле (одноатомные спирты, или алкоголи), известны спирты, молекулы которых содержат несколько гидроксильных групп (многоатомные спирты).
Примерами таких спиртов могут служить двухатомный спирт этиленгликоль и трехатомный — глицерин:
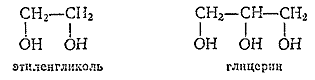
Этиленгликоль и глицерин - высококипящие жидкости сладкого вкуса, смешивающиеся с водой во всех отношениях. Этилен-гликоль применяется в качестве составной части так называемых антифризов, т. е. веществ с низкой температурой замерзания, заменяющих воду в радиаторах автомобильных и авиационных моторов в зимнее время. Водный раствор этиленгликоля (58 %-ный) замерзает только при температуре -50оС. Этиленгликоль применяется и для изготовления синтетического волокна лавсан. При приеме внутрь — сильно ядовит.
Азотнокислые эфиры этиленгликоля и глицерина
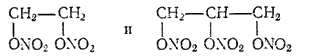
неправильно называемые нитроэтиленгликолем и нитроглицерином, обладают сильными взрывчатыми свойствами и применяются для изготовления динамитов.
Фенолы
Производные ароматических углеводородов с группой ОН в бензольном ядре называются фенолами. Так, фенол C6H5 — OH — производное бензола C6H6 — простейший представитель класса фенолов.
Фенолы при обычных условиях находятся, как правило, в кристаллическом состоянии.
Общим свойством спиртов и фенолов является подвижность водорода гидроксильной группы. Так, при действии на спирт щелочного металла этот водород вытесняется металлом и получаются твердые, растворимые в спирте соединения, называемые алкоголятами, например:
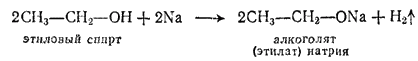
Формально такая реакция напоминает образование солей из кислот, однако алкоголяты подобны солям очень слабых кислот и нацело гидролизуются водой; при этом снова образуются спирт и щелочь:
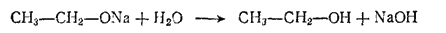
Поэтому при взаимодействии спиртов с водными растворами щелочей алкоголяты не образуются.
В фенолах под влиянием ароматического бензольного ядра подвижность водорода гидроксильной группы выше. Они образуют металлические производные — феноляты — не только при действии щелочных металлов, но, в отличие от спиртов, и при действии щелочей:
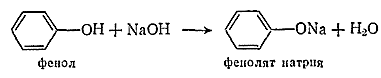
Феноляты в отличие от алкоголятов водой не разлагаются, но все же и они в водных растворах, подобно солям слабых кислот и сильных оснований, частично гидролизованы и их растворы имеют щелочную реакцию. Фенол вытесняется из фенолята даже угольной кислотой.
Спирты практически не являются электролитами. Константа диссоциации этилового спирта близка к 10-18, тогда как константа диссоциации воды - к 10-16, т. е. этиловый спирт является более слабой кислотой, чем вода. Константа диссоциации фенола несколько выше (1,3*10-10).
Спирты и фенолы взаимодействуют с кислотами, образуя сложные эфиры, например
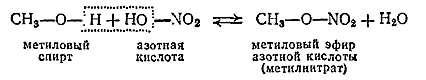
Особый интерес представляют сложные эфиры спиртов и фенолов с органическими кислотами.
Спирты значительно легче окисляются, чем соответствующие углеводороды. При этом образуются альдегиды пли кетоны.
Фенол C6H6OH — бесцветные кристаллы (темп, плавл. 41oC). Обладает характерным запахом и антисептическими (обеззараживающими — подавляющими развитие вредных микроорганизмов) свойствами.
Кислотные свойства гидроксильного водорода выражены у фенола значительно сильнее, чем у спиртов; замещение этого водорода металлом может происходить не только при действии щелочных металлов, но и при действии щелочей. Поэтому фенол называют также карболовой кислотой.
Фенол содержится в каменноугольной смоле, а также получается синтетически из бензола. В больших количествах он идет на синтез лекарственных веществ, красителей, пластических масс (фенопластов), для очистки нефтяных смазочных масел.
АЛЬДЕГИДЫ
Альдегиды — класс органических соединений, в молекулах которых содержится карбонильная группа > C=O связанная с органическим радикалом и атомом водорода. Свойства альдегидов во многом сходны со свойствами кетонов. У альдегидов карбонильная группа связана с атомом водорода и углеводородным радикалом, у кетонов — с двумя углеводородными радикалами:

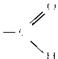
Группу атомов — называют функциональной группой альдегидов.
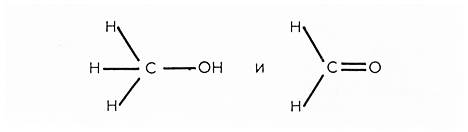
«Альдегид» — сокращение от латинских слов, означающих «спирт, лишенный водорода». Действительно, если сравнить химические формулы альдегида и соответствующего ему спирта (имеющего то же число атомов углерода в молекуле), то можно видеть, что они отличаются друг от друга на два атома водорода: CH2O — муравьиный альдегид, CH3OH — метиловый спирт. Однако строение их различно: в молекуле спирта атом кислорода соединен с атомом углерода простой связью, а в альдегиде — двойной:
Карбонильная группа определяет специфические свойства альдегидов: за счет разрыва двойной связи они легко вступают в реакции присоединения.
Простейшие альдегиды: HCHO — муравьиный, или формальдегид; CH3CHO — уксусный, или ацетальдегид. Они приобрели наибольшее практическое значение. Некоторые высшие альдегиды применяются как душистые вещества.
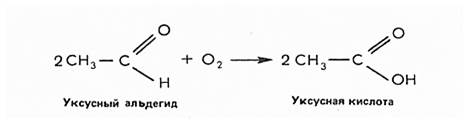
В отличие от кетонов альдегиды легко окисляются, превращаясь в карбоновые кислоты. Так, при окислении уксусного альдегида образуется уксусная кислота, которая широко используется в промышленности и быту:
Альдегиды склонны к полимеризации. Например, формальдегид превращается в параформальдегид и т. д.
Основной промышленный способ получения формальдегида — окисление метилового спирта кислородом воздуха в присутствии металлических катализаторов. Формальдегид — бесцветный газ с резким, неприятным запахом, хорошо растворимый в воде. Он обладает антисептическими (обеззараживающими), а также дубящими свойствами.
40%-ный раствор муравьиного альдегида, называемый формалином, применяется для дезинфекции, для консервирования анатомических препаратов, в сельском хозяйстве для протравливания семян перед посевом.
Формальдегид используется, в частности, в промышленности для производства пластических масс (полиформальдегида, фенолоформальдегидных и других полимеров).
Уксусный альдегид можно получить присоединением воды к ацетилену в присутствии катализатора (солей ртути):
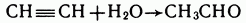
Эта реакция была открыта русским ученым М. Г. Кучеровым в 1881 г. и носит его имя — реакция Кучерова.
В настоящее время в промышленности уксусный альдегид все более получают каталитическим окислением этилена:

Просмотров: 2224
Вернуться в категорию: Вода
|
© Беляев М.И., "МИЛОГИЯ"
Сайт ЯВЛЯЕТСЯ ТВОРЧЕСКОЙ МАСТЕРСКОЙ АВТОРА, открытой для всех посетителей. Убедительная просьба сообщать о всех замеченных ошибках, некорректных формулировках. Книги " Основы милогии ", " Милогия " могут быть высланы в Ваш адрес наложенным платежом, e-mail: [email protected] |