- Общие сведения [ ред. | ред. код ]
- Механизм трансляции прокариот [ ред. | ред. код ]
- элонгация [ ред. | ред. код ]
- Терминация и переработка [ ред. | ред. код ]
- полисомы [ ред. | ред. код ]
- Механизм трансляции эукариот [ ред. | ред. код ]
- Кэп-независимая инициация [ ред. | ред. код ]
- элонгация [ ред. | ред. код ]
- Терминация [ ред. | ред. код ]
- принцип [ ред. | ред. код ]
- Таблицы трансляции [ ред. | ред. код ]
- Компьютерная трансляция [ ред. | ред. код ]
В Википедии есть статьи о других значение этого термина: трансляция .
Трансляция - синтез белков с аминокислот , Катализируемой рибосомой на матрице матричной РНК (МРНК). Трансляция является одной из стадий биосинтеза белков , А он, в свою очередь, - часть процесса экспрессии генов .
Трансляция происходит в цитоплазме , Где находятся рибосомы клетки. Во время трансляции информация, содержащаяся в мРНК, расшифровывается согласно правилам, известными как генетический код И используется для синтеза закодированной полипептидной последовательности. Процесс трансляции можно разделить на четыре фазы: активацию, инициацию, элонгацию и терминацию.
При активации соответствующая аминокислота присоединяется к соответствующей транспортной РНК (ТРНК). Хотя эта стадия часто рассматривается отдельно от трансляции, она необходима для ее начала. Связана с аминокислотой тРНК называется аминоацил-тРНК, или «заряженной» тРНК. При инициации имела субъединица рибосомы связывается с 5'-концом мРНК с помощью факторов инициации (IF) и других белков, помогают процессу. Элонгация происходит, когда очередная аминоацил-тРНК используется для увеличения полипептидной цепочки. Терминация происходит, когда рибосома встречает стоп-кодон (UAA, UAG или UGA), для которого не существует соответствующей тРНК; при этом происходит освобождение полипептидной цепочки.
Общие сведения [ ред. | ред. код ]
Для осуществления трансляции в клетках всех без исключения организмов существуют специальные органеллы - рибосомы . рибосомы являются рибонуклеопротеиднимы комплексами, построенными из 2 субъединиц: большой и малой. Функция рибосом заключается в распознавании тринуклеотидних кодонов мРНК, подбора соответствующих им аминокислот и присоединении этих аминокислот к белковому цепочки, растет. Двигаясь вдоль молекулы мРНК, рибосома распознает кодон за кодоном и синтезирует белок в соответствии информации, заложенной в молекуле мРНК.
Для распознавания аминокислот в клетке существуют специальные «адаптеры», молекулы транспортной РНК (ТРНК). Эти молекулы, имеющие форму клеверного листа, имеют участок (антикодон), комплементарную кодона мРНК, и другой участок, к которому присоединяется аминокислота, соответствующая этому кодона. Присоединение аминокислот к тРНК осуществляется в екзоенергетичний реакции ферментами аминоацил-тРНК синтетазы , А молекула, получаемая в результате, называется аминоацил-тРНК. Таким образом, специфичность трансляции определяется взаимодействием между кодоном мРНК и антикодоном тРНК, а также специфичностью аминоацил-тРНК-синтеназ, что присоединяют аминокислоты строго к соответствующим им тРНК (например, кодона GGU отвечать тРНК, содержит антикодон CCA, а к этой тРНК будет присоединяться только аминокислота глицин ).
механизмы трансляции прокариот ( бактерий и архей ) и эукариот существенно отличаются, поэтому многие вещества, подавляющие прокариотических трансляцию, в значительно меньшей степени действуют на трансляцию эукариотических организмов, что позволяет использовать их в медицинской практике как антибактериальные средства, безопасные для организма млекопитающих.
Поскольку каждый кодон содержит три нуклеотиды Один и тот же генетический «текст» можно прочитать тремя разными способами (начиная с первого, второго и третьего нуклеотидов), то есть в трех разных рамках считывания . По некоторым интересными исключениями, значимой является информация, закодированная только в одной рамке считывания. По этой причине крайне важным для синтеза белка рибосомой является ее правильное позиционирование на стартовом AUG-кодоне - во время инициации трансляции.
Механизм трансляции прокариот [ ред. | ред. код ]
инициация [ ред. | ред. код ]
Синтез белка всегда начинается с AUG-кодона, также кодирует метионин . Этот кодон обычно называют стартовым или инициаторным. Инициация трансляции предусматривает узнавание рибосомой этого кодона и привлечение инициаторной аминоацил-тРНК. Для инициации трансляции необходимо также наличие определенных нуклеотидных последовательностей в районе стартового кодона. Существование последовательности, отличающей стартовый AUG от внутренних, совершенно необходимо, поскольку иначе инициация синтеза белка происходила бы хаотично на всех AUG-кодонов.
Процесс инициации обеспечивается специальными белками - факторами инициации ( англ. initiation factors, сокращенно IF).
Малая рибосомная субъединица (30S) прокариот, если она не вовлечена в это время в трансляцию, существует в комплексе с факторами инициации IF1, IF3 и, в некоторых случаях, IF2:
- IF3, связанный с 30S-субъединицей, предотвращает ассоциации с большой (50S) субъединицей рибосомы, тем самым сохраняя ее свободное состояние до связывания с матричной РНК. Этот белок также участвует в связывании мРНК и тРНК, а также IF2;
- IF2 взаимодействует с тРНК, а также обладает способностью расщеплять ГТФ ;
- IF1 является, пожалуй, необязательным фактором (в некоторых видов он отсутствует), который повышает сродство малой субъединицы к IF2 и IF3.
Комплекс 30S-субъединицы с инициаторным факторами способен распознавать специальные последовательности мРНК, так называемые участки связывания рибосомы ( англ. ribosomt-binding site или RBS). Эти участки содержат, во-первых, инициаторным кодон AUG и, во-вторых, специальную последовательность Шайн-Дальгарно, с которой комплементарно связывается рибосомная 16S РНК . Последовательность Шайн-Дальгарно служит для того, чтобы отличить инициаторным AUG от внутренних кодонов, кодирующих метионин. После того, как 30S-субъединица связалась с мРНК, к ней привлекается инициаторным аминоацил-тРНК и IF2, если они еще не были включены в комплекс. Затем присоединяется 50S-субъединица, происходит гидролиз ГТФ и диссоциация факторов инициации. Собранная рибосома начинает синтезировать полипептидную цепочку.
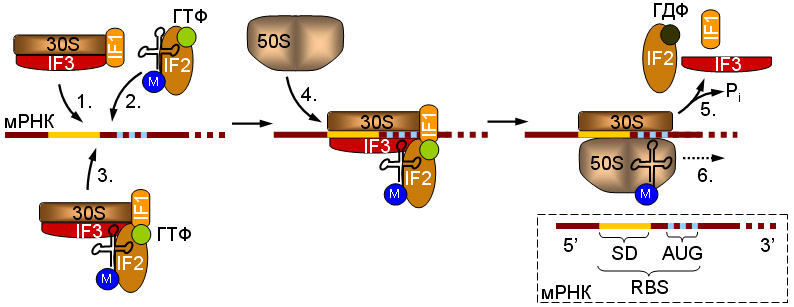
Схема инициации трансляции у прокариот.
Начальная стадия предусматривает связывание малой рибосомной субъединицы (30S) с мРНК. Это может происходить двумя способами: либо сначала к мРНК присоединяется комплекс, содержащий рибосомную субъединицу (1), а затем к нему привлекается тРНК в комплексе с IF2 и ГТФ (2), или 30S-субъединица сначала связывается с тРНК, а уже затем садится на мРНК (3). В комплекс, образовавшийся присоединяется большая (50S) рибосомная субъединица (4), факторы инициации отсоединяются от 30S-субъединицы, сопровождается гидролизом ГТФ белком IF2 (5) и собранная рибосома начинает елонгуваты цепочка (6).
В правом нижнем углу данная схема инициаторной участка прокариотической мРНК. Отмеченные 5'и 3'-конце молекулы. RBS - участок связывания рибосомы, SD - последовательность Шайн-Дальгарно, AUG - инициаторным кодон.
элонгация [ ред. | ред. код ]
Элонгация полипептидной цепочки заключается в добавлении новых аминокислот в карбоксильного (C-) конца цепочки, растет. Этот полипептидную цепочку выходит из рибосомы через выходной туннель в большой субъединицы.
Элонгация начинается, когда метилированных аминоацил-тРНК связывается с участком P, приводит к конформационной изменения комплекса, открывает участок A для связывания новой аминоацил-тРНК. Это связывание облегчается фактором элонгации Tu (EF-TU), малой ГТФазою. В этот момент участок P содержит начало полипепдидного цепочки, синтезируется, а участок A содержит следующую аминокислоту, которая должна быть добавлена к цепочке. После этого полипептид отделяется от тРНК в области P и пептидный связь формируется между последней аминокислотой полипептида и аминокислотой, все еще присоединена к тРНК в области A. Этот процесс, известный как образование пептидной связи, катализируемой рибозимов , пептидилтрансферазою , Такая активность свойственна к 23S-рРНК большой (50S) рибосомной субъединицы. После образования пептидной связи участок A содержит полипептид, тогда как участок P содержит незаряженную тРНК (тРНК без аминокислоты).
На конечной стадии элонгации рибосома перемещается на три нуклеотида в направлении 3'-конца мРНК. Так что тРНК связанные с мРНК за счет спаривания кодон-антикодон, тРНК движется относительно рибосомы, двигая полипептид с участка A в область P, а незаряженная тРНК перемещается в область выхода (участок E). Этот процесс катализируется фактором элонгации G (EF-G).
Рибосома продолжает транслировать кодоны оставшиеся потому что новые аминоацил-тРНК звьязуютьться с участком A, пока рибосома не встретит кодон остановки на мРНК (UAA, UGA или UAG).
Терминация и переработка [ ред. | ред. код ]
Терминация происходит, когда один из трех стоп-кодонов перемещается в область A. Эти кодоны не имеют соответствующих тРНК. Зато их признают специальные белки - факторы терминации ( англ. release factors, RF), а именно RF1 (распознающий стоп-кодоны UAA и UAG) или RF2 (распознающий стоп-кодоны UAA и UGA). Третий фактор освобождения RF-3 катализирует освобождение RF-1 и RF-2 в конце процесса терминации. Эти факторы катализируют гидролиз эфирного связи, связывающей тРНК с пептидом, и высвобождение недавно синтезированного белка с рибосомы.
Пост-терминационного комплекс, сформированный после терминации, состоит из мРНК со стоп-кодоном в области A рибосомы и тРНК. Шаг переработки рибосомы отвечает за разборку пост-трансляционного рибосомного комплекса. Как только протеин, который синтезируется, освобождается после терминации, факторы переработки рибосомы и фактор элонгации EF-G освобождают мРНК и тРНК с рибосомы и разъединяют 70S-рибосомы на 30S- и 50S-субъединицы. IF-3 также помогает процессу переработки, предотвращая повторное связывание субъединиц за счет связывания с 30S субъединицей. Этот процесс готовит рибосому для повторения цикла трансляции.
полисомы [ ред. | ред. код ]
Трансляция обычно осуществляется более чем одной рибосомой одновременно. Из-за относительно большой размер рибосом они могут связываться с участками мРНК на расстоянии не менее 35 нуклеотидов. Несколько рибосом и молекула мРНК, по которой они движутся, называются полисомы, или полирибосомами.
Механизм трансляции эукариот [ ред. | ред. код ]
Кэп-зависимая инициация [ ред. | ред. код ]
С помощью этого механизма транслируется подавляющее число эукариотических мРНК. Белки, участвующие в процессах инициации трансляции у эукариот называют eIF ( англ. eukaryotic Initiation Factors - эукариотические факторы инициации). Кроме факторов инициации eIF1, eIF2 и eIF3, связывающиеся с малой рибосомной субъединицей (40S), и по своим функциям приблизительно аналогичными соответствующим белкам прокариот, эукариоты имеют две группы факторов инициации: семейство факторов, связывающих мРНК - eIF4 и семейство факторов, связываются с большой (60S) субъединицей рибосомы, eIF5. Ниже приведен список основных факторов:
- eIF4A - РНК геликаза , Фермент, расплетает вторичную структуру мРНК для того, чтобы рибосома могла по ней двигаться;
- eIF4B - привлекает фактор eIF4A к молекуле мРНК;
- eIF4E - связывает кэп 7-метилгуанин, расположенный на 5'-конце молекулы мРНК;
- eIF4G - нужен для организации компонентов, участвующих в инициации трансляции, в единый комплекс. Содержит участки связывания eIF4B, eIF4E, рибосомы;
- eIF5 - нужен для привлечения большой субъединицы рибосомы.
На первом этапе инициации трансляции имела субъединица рибосомы в комплексе с факторами инициации eIF4G, eIF4B, eIF4E и инициаторным тРНК присоединяется к 5'-концу мРНК за счет способности eIF4E связывать кэп-структуру, а белка eIF3 - мРНК. Затем белок eIF4B привлекает геликазу eIF4A, и та начинает расплетать мРНК в направлении 3'-концу, что сопровождается затратами энергии в форме молекул АТФ . За счет работы этого белка 40S-субъединица освобождается от белков eIF4G и eIF4E, и в комплексе с факторами инициации оставшиеся движется по мРНК к инициаторным кодона AUG, где происходит диссоциация факторов инициации оставшиеся и привлечения 60S-субъединицы рибосомы с помощью eIF5, после чего начинается синтез полипептидной цепочки.
Кэп-независимая инициация [ ред. | ред. код ]
Тогда как в большинстве случаев эукарио трансляция требует наличия кэпа на 5'-конце мРНК, некоторые вирусные и клеточные мРНК обходят кэп-зависимый механизм за счет инициации трансляции на определенных последовательностях внутри молекулы РНК.
Лучше исследованным (но далеко не единственным) примером кэп-независимой трансляции у эукариот является так называемая «Внутренняя участок входа рибосомы» ( англ. Internal Ribosome Entry Site или IRES). В отличие от кэп-зависимого механизма, кэп-независимый механизм также не требует сканирования рибосомой от 5'-конца рибосомы в стартовый кодона. Рибосома могу быть доставлена в стартовой участки IRIS с помощью ITAFьив, (IRES trans-acting fantors), позволяющие обходить необходимость сканирования от 5'-конца РНК.
Этот метод трансляции был найден относительно недавно и является необходимым при этих условиях, которые требуют трансляции определенных мРНК в стрессовых условиях, когда общая эффективность трансляции уменьшена. Примеры включают факторы, вызывающие апоптоз , иммуноглобулины некоторые факторы роста . Кроме того, этим механизмом иногда пользуются вирусы [1] .
элонгация [ ред. | ред. код ]
Элонгация трансляции эукариот очень похожа на элонгации трансляции прокариот. Основными факторами элонгации являются:
- eEF-1, чьи α- и βγ-субъединицы отвечают прокариотических факторам EF-TU и EF-TS соответственно;
- eEF-2, что соответствует прокариотических фактора EF-G.
Терминация [ ред. | ред. код ]
У эукариот существует только один фактор высвобождения, eRF, вместо трех факторов прокариот. Однако в целом процесс терминации подобен процессу терминации прокариот [2] .
принцип [ ред. | ред. код ]
Для определения полипептидной последовательности возможно провести процесс переложения последовательности ДНК в последовательность аминокислот, так называемую «трансляцию вручную» (для коротких последовательностей) или трансляцию на компьютере. На первом этапе необходимо перевести последовательность ДНК в последовательность РНК, заменяя нуклеотиды A, T, C, G в ДНК на U, A, G, C в РНК, соответственно.
Затем РНК разбивается на тринуклеотидних последовательности (кодоны). Отметьте, что существует 3 «рамки считывания», или способы интерпретации кода в зависимости от того, на каком нуклеотиде начнется трансляция.
Наконец, используется так называемая «таблица трансляции» для перевода каждого кодона в соответствующую аминокислоту. В результате получается первичная структура белка.
Однако белок также имеет структуру высшего порядка (вторичную, третичную и четвертичную) или конформацию, которая определяется наличием гидрофобных и электростатических взаимодействий между частями полипептидной цепочки. Тогда как вторичная структура (структура «доменов» - коротких участков белка) еще может буди предусмотрена с помощью последовательности, надлежащая третичная структура обычно тяжелая для определения теоретически, и даже в природе выбор третичной структуры часто зависит от взаимодействия с другими белками.
Трансляция вручную в некоторых случаях также не дает правильной аминокислотной последовательности природного белка, особенно если кодируется нестандартная аминокислота, например селеноцистеин , Который кодируется с помощью обычного стоп-кодона UGA и специального «шпилькоподибного» РНК-мотива, так называемого SECIS-элемента .
Таблицы трансляции [ ред. | ред. код ]
Для большинства эукариот обычно используется стандартная таблица трансляции, в которой каждой аминокислоте соответствует одна или несколько последовательностей ДНК: (см. NCBI Taxonomy ).
AAs = FFLLSSSSYY ** CC * WLLLLPPPPHHQQRRRRIIIMTTTTNNKKSSRRVVVVAAAADDEEGGGG Starts = --- M --------------- M --------------- M ---- ------------------------ Base1 = TTTTTTTTTTTTTTTTCCCCCCCCCCCCCCCCAAAAAAAAAAAAAAAAGGGGGGGGGGGGGGGG Base2 = TTTTCCCCAAAAGGGGTTTTCCCCAAAAGGGGTTTTCCCCAAAAGGGGTTTTCCCCAAAAGGGG Base3 = TCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAG
Не все организмы используют одинаковый генетический код. Даже работая с генетическими последовательностями обычных эукариотических организмов, например дрожжей , Часто желательно использовать альтернативные таблицы трансляции - а именно для транслиции митохондриальных генов . сейчас группа таксономии NCBI определяет следующие таблицы для последовательностей, содержащий GenBank (Таблицы см. NCBI Taxonomy ):
1 установлен код 2: Митохондриальный код позвоночных 3: Митохондриальный код дрожжей 4: Митохондриальный код слизистых грибков, протозоа и кишковопорожниних и микоплазмы / спироплазма 5: Митохондриальный код беспозвоночных 6: Ядерный код жгутиковых, Dasycladacea и Hexamita 9: Митохондриальный код голошкирих и Плоский червей 10: Ядерный код Euplotida 11: Бактериальный код и пластидних код растений 12: Альтернативный ядерный код дрожжей 13: Митохондриальный код асцидий 14: Альтернативный митохондриальный код плоских червей 15: Ядерный код Blepharisma 16: Митохондриальный код Chlorophycea 21: Митохондриальный код Trematoda 22: Митохондриальный код Scenedesmus obliquus 23: Митохондриальный код Thraustochytrium
Компьютерная трансляция [ ред. | ред. код ]
Существует много компьютерных программ, способных к трансляции последовательности ДНК / РНК в белковую последовательность. Однако немного программ способны выдавать правильную последовательность во всех «особых» случаях, таких как использование альтернативных инициаторных кодонов. Например редкий код альтернативного кодона инициации TTG используется для метионина При использовании как инициаторным кодон, и для лейцина в остальных случаях.
- ApE Компьютерная программа трансляции (Mac, Windows, Unix)
- ExPASy Translate Tool Компьютерная программа трансляции (webserver)
- Virtual Ribosome Компьютерная программа трансляции (webserver, cross-platform command-line)
- Pamela C Champe, Richard A Harvey and Denise R Ferrier (2005). Lippincott's Illustrated Reviews: Biochemistry (3rd ed.). Lippincott Williams & Wilkins. ISBN 0-7817-2265-9 .
- David L. Nelson and Michael M. Cox (2005). Lehninger Principles of Biochemistry (4th ed.). WH Freeman. ISBN 0-7167-4339-6 .
 МОЯ ТВОРЧЕСКАЯ ЛАБОРАТОРИЯ
МОЯ ТВОРЧЕСКАЯ ЛАБОРАТОРИЯ